(Ⅰ)混合物的分离与提纯在化学实验中占有重要的位置。下图表示从固体混合物中分离X的方案,请回答有关问题。
(1)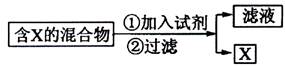
若按照以上图示从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是 ,有关反应的化学方程式为 ;
(2)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),请设计一种以框图形式表示的实验方案(注明物质和操作) 。
(Ⅱ)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。
(1)该工艺的中间过程会发生反应: ,反应的氧化剂是______________,氧化产物为__________
,反应的氧化剂是______________,氧化产物为__________
(2)在精炼铜的过程中,电解液中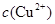 逐渐下降,
逐渐下降,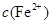 、
、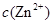 会逐渐增加,所以需定时除去其中的
会逐渐增加,所以需定时除去其中的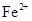 、
、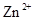 。下表为几种物质的溶度积。
。下表为几种物质的溶度积。
| 物质 |
 |
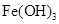 |
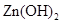 |
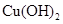 |
溶度积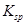 |
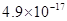 |
 |
 |
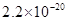 |
甲同学设计了如下除杂方案: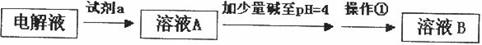
①试剂a是__________,其目的是____________________________________;根据溶度积该方案能够除去的杂质金属阳离子是____________。写出检验该杂质金属阳离子的操作方法:____________________________________________________________________________.
②乙同学在查阅资料时发现,“工业原料氯化铵中含杂质氯化铁,使其溶入水,再加入氨水
调节pH至7~8,可使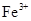 生成
生成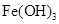 。沉淀而除去。”乙同学认为甲同学的方案中也
。沉淀而除去。”乙同学认为甲同学的方案中也
应该将溶液pH调至7~8。你认为乙同学的建议是否正确?________(填“是”或“否”),
理由是________________________________________________________________________。
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)==Si3N4(s)+ 6CO(g)
(1)该反应的氧化剂是,其还原产物是;
(2)该反应的平衡常数表达式为K= ;
(3)若知上述反应为放热反应,则其反应热△H0(填“>”、“<”或“=”);升高温度,其平衡常数值(填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)=
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率 与时间t的关系如右图。图中t4时引起平衡移动的条件可能是;图中表示平衡混合物中CO的含量最高的一段时间是。
与时间t的关系如右图。图中t4时引起平衡移动的条件可能是;图中表示平衡混合物中CO的含量最高的一段时间是。
(5)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是(提示:272 = 729)
某中学化学兴趣小组在课外活动时,对学校附近的甲、乙两条河流的水质进行了多次检测。第一组检测甲河流的水质结果如下:
| 检测次数 |
溶液中检测出的溶质 |
| 第一次 |
KCl K2SO4Na2CO3 NaCl |
| 第二次 |
KCl BaCl2 Na2SO4K2CO3 |
| 第三次 |
Na2SO4KCl K2CO3NaCl |
(1)三次检测结果中第次的结果肯定不正确。
(2)在检测时,为了确定溶液中是否存在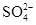 、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。
、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。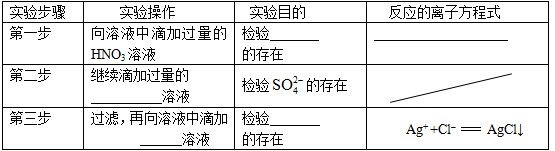
(3)第二组对乙河流进行检测,乙河流两边有甲、乙两工厂,经检测它们排放的工业废水中共含有K+、Ag+、Fe3+、、Cl–、OH–、 六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为、、。
六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为、、。
已知有以下物质相互转化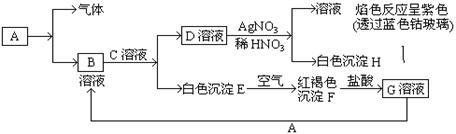
试回答:(1)写出B的化学式,D的化学式。
(2)写出由E转变成F的化学方程式。
(3)写出F转化成G的离子方程式;
(8分)以 ①2NaOH+ Cl2 NaCl+NaClO+H2O② 2Na + Cl2
NaCl+NaClO+H2O② 2Na + Cl2 2NaCl
2NaCl
③ 2Fe3+ + 2I– 2Fe2+ + I2 ④ 2Fe2+ + Br2
2Fe2+ + I2 ④ 2Fe2+ + Br2 2Fe3+ + 2Br–
2Fe3+ + 2Br–
这四个反应为例,我们来探究氧化还原反应。
(1)氧化还原反应的本质是。
(2)对于反应①,氧化剂是。
(3)对于反应②,Na的化合价由0价变成+1价,化合价升高的原因是。
(4)由③、④两反应,可以推断Fe3+、Br2、I2的氧化性强弱顺序为。
(1)鉴别KCl溶液和K2CO3的试剂是 ,离子方程式为 。
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是 ,离子方程式为 。
(3)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 。(3分)