课本实验设计得简要明了,但也常存在一些不足,在学习过程中对其进行分析与改进是研究性学习的一个重要课题。
Ⅰ.草酸晶体(H2C2O4·2H2O)受热易分解(分解温度为175℃),产生CO和CO2。关于草酸晶体受热分解及验证部分分解产物的实验装置如图。
(1)写出草酸晶体受热分解的化学方程式:
__________。
(2)设计该装置欲验证的分解产物是 。
(3)草酸晶体的某些物理性质如下表:
| |
分子式 |
颜色、状态 |
水溶性 |
熔点/℃ |
密度/g·cm—3 |
| 草酸晶体 |
H2C2O4·2H2O |
无色晶体 |
易溶于水 |
101.5 |
1.650 |
有同学认为,用该装置进行实验,存在着不合理因素,请分析指出(任答两点):
①
②
Ⅱ.下图甲是 “铜丝在氯气中燃烧”的演示实验,铜丝在氯气中燃烧的主要现象是 。有人对该实验提出了如下改进方案:
①按下图乙所示连接好装置,并检查气密性;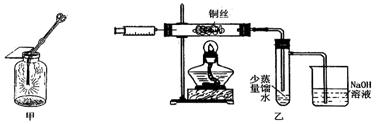
②取下注射器并集满Cl2;
③点燃酒精灯加热1~2min后,再移开酒精灯。迅速将注射针插入石英玻璃管内,并将Cl2缓缓推入玻璃管中;
④拔出针头,再用同样方法快速向玻璃管中推入空气。请回答:
(1)步骤③中,移开酒精灯、推入Cl2时,观察到铜丝继续保持红热状态,由此可判断,该反应为 反应(填“放热”或“吸热”)。 (2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离方程式为 。
(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离方程式为 。
(3)改进后的实验与课本实验相比较,其优点为
______________。
海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
(1)实验室焙烧海带,需要下列仪器中的________(填序号)。
a.试管 b.烧杯
c.坩埚 d.泥三角
e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①________,③__________。
(3)提取碘的过程中,可选择的有机试剂是 ( )
| A.甲苯、酒精 | B.四氯化碳、苯 |
| C.汽油、乙酸 | D.汽油、甘油 |
(4)③过程需要使用的主要玻璃仪器为______________。
(5)某小组用CCl4萃取碘水中的碘,在如图的分液漏斗中,下层液体呈 ______色;他们打开分液漏斗活塞,却未见液体流下,原因可能是___________。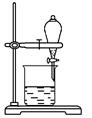
(6)从含碘的有机溶液中提取碘和回收有机溶剂,所用的分离方法为
某课外活动小组结合以下材料制酚醛树脂。用苯酚和甲醛为原料,在酸或碱的催化作用下缩聚而成。苯酚过量,在酸性催化剂作用下,缩聚成线型结构的热塑性酚醛树脂。甲醛过量,在碱性催化剂作用下,缩聚成体型结构的热固性酚醛树脂。设计实验如下:
Ⅰ.用盐酸作催化剂
在一个大试管里加入苯酚2 g,注入3 mL甲醛溶液和3滴浓盐酸混合后,用带有玻璃管的橡皮塞塞好,放在沸水浴里加热约15 min。待反应物接近沸腾时,液体变成白色浑浊状态。从水浴中取出试管,用玻璃棒搅拌反应物,稍冷。将试管中的混合物倒入蒸发皿中,倾去上层的水,下层就是缩聚成线型结构的热塑性酚醛树脂(米黄色中略带粉色)。它能溶于丙酮、乙醇等溶剂中。
Ⅱ.用浓氨水作催化剂
在另一个试管里加入2.5 g苯酚,注入3 mL~4 mL 40%的甲醛溶液,混匀后再加1 mL浓氨水,振荡混合,也用带有玻璃管的橡皮塞塞好,在水浴中加热(装置如下图)。约15 min后,试管里逐渐出现白色的浑浊物,暂停加热。待发生的气泡稍少时,再继续加热,过一会儿,就变成黏稠的半流动性液体。将所得黏稠物倒入一瓷蒸发皿里,在50 ℃下烘1 h后,再继续在70~80 ℃下烘8 h,即能缩合成体型固体酚醛树脂(淡黄色),它不溶于任何溶剂。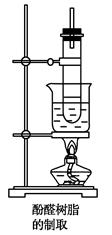
(1)写出酸性条件下生成酚醛树脂的反应方程式。
①________________________________________________________________________;
②________________________________________________________________________。
(2)实验装置采用沸水浴加热的原因
________________________________________________________________________
________________________________________________________________________。
(3)长玻璃导管起的作用为
________________________________________________________________________
________________________________________________________________________。
下图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:
(1)在圆底烧瓶中加入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水和10 mL酒精,加入酒精的作用是__________________________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成,所得的混合物为________(选填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入________,静置一段时间后,溶液分为上下两层,肥皂在________层,这个操作称为____________。
(4)图中长玻璃导管的作用为
________________________________________________________________________。
(5)写出该反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
氧化镁分轻质氧化镁和重质氧化镁两种。轻质体积疏松,为白色无定形粉末。无臭无味无毒。密度3.58g/cm3。难溶于纯水及有机溶剂,在水中溶解度因二氧化碳的存在而增大。能溶于酸、铵盐溶液。经高温灼烧转化为结晶体。遇空气中的二氧化碳生成碳酸镁复盐。重质体积紧密,为白色或米黄色粉末。与水易化合,露置空气中易吸收水分和二氧化碳。与氯化镁溶液混合易胶凝硬化。在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(1)MgCO3与稀硫酸反应的离子方程式为_______ _______________。
(2)加入H2O2氧化时,发生反应的化学方程式为______ _______________。
(3)加氨水调节至溶液的ph=4的目的:
滤渣2的成分是______(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C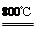 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。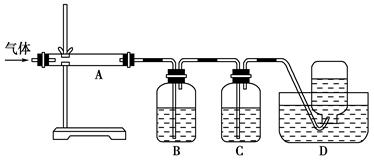
①D中收集的气体是________(填化学式)。
②B中盛放的溶液可以是________(填字母)。
a.NaOH溶液 b.KMnO4溶液 c.稀硝酸 d.Na2CO3溶液
并写出相应的离子反应方程式:
③A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,
写出该反应的离子方程式:_________________________________________。
聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
(1)验证固体W焙烧后产生的气体含有SO2的方法是________________。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→________→________→________→________→f。
装置A中发生反应的化学方程式为___________________。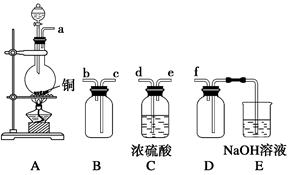
(3)制备绿矾时,向溶液X中加入过量________,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准 溶液,用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数________(填“偏大”、“偏小”或“无影响”)。