乙二酸通常以二水合物的形式存在,俗称草酸晶体.已知草酸晶体在101℃时熔化并开始升华,157℃时大量升华,继续升温会分解生成CO、CO2和H2O.
(1)下列关于乙二酸的叙述正确的是(填编号)________________.
①能和乙二醇发生酯化反应 ②能使酸性高锰酸钾溶液褪色
③其溶液能使蓝色石蕊试纸变红 ④能和碳酸氢钠溶液反应生成气体
(2)乙二酸的工业生产方法之一是以乙二醇为原料,在一定条件下,用空气氧化得到.写出该反应的化学反应方程式 :_____________________________________________________________________。
(3)欲检验草酸晶体受热分解的产物中是否有CO2,甲、乙两位同学分别设计了装置1、装置2来完成实验.
(I)简述检验装置1气密性的操作方法 :_________________________________________________。
(II)B和E两个装置中更合理的是________,理由为: __________________________________。
(III)请从A~F中选择合适的仪器,组装一套可更好达到实验目的装置,按照气流由左到右的顺序依次为(用字母表示):_________________。
(Ⅳ)一定条件下草酸氢铵分解生成NH3、CO、CO2和H2O,110℃时将该混合气体先通过Na2O2,再通过浓硫酸分别增重Ag和Bg ; 若将混合气体先通过浓硫酸,再通过Na2O2分别增重Cg和Dg(能反应的气体均可吸收完全,且该条件下CO与Na2O2不反应),则A、B、C、D的大小关系为:
___________________________。
高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:
在烧瓶中(装置见下图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O)。
①石灰乳参与反应的化学方程式为 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 。
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如下图。
导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是 。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7。请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
①边搅拌边加入 ,并控制溶液pH ;
② ;
③检验SO42-是否被洗涤干净;(实验操作: )
④用少量C2H5OH洗涤;
⑤ 。
海带、海藻中丰富的碘元素主要以碘化钾的形式存在.化学小组欲用海带制取少量碘单质,先将海带烧成灰,再用水浸泡一段时间(让碘化物充分溶解),得到海带灰悬浊液,然后按以下流程提取单质碘(已知:2I﹣+Cl2=2Cl﹣+I2).
(1)过程 ①中使用的玻璃仪器__________;
(2)过程②中充入适量Cl2的目的是__________;
(3)提取碘的过程中实验操作③的名称:__________,选择的有机试剂可以是__________(填序号);
A.酒精 B.四氯化碳 C.醋酸 D.苯
(4)过程③中有以下操作.
①倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,放正分液漏斗;
②把50ml碘水和15ml有机溶剂加入分液漏斗中,并盖好玻璃塞;
③将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
④把盛有溶液的分液漏斗放在铁架台的铁圈中,静置、分层;
⑤从分液漏斗上口倒出上层液体.
⑥旋开分液漏斗下面的活塞,用烧杯接收下层液体;
⑦检验分液漏斗活塞和上口的玻璃塞是否漏液;
操作顺序正确的是__________(填字母).
A.⑦①②③④⑤⑥ B.⑦②①④③⑥⑤
C.⑦①②④③⑥⑤ D.⑦②①③④⑥⑤
(5)过程 ④从含碘的有机溶液中提取碘并回收有机溶剂,还需要经过蒸馏、冷凝(如图).则冷水的流向为__________.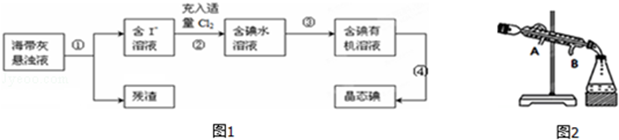
某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250mL容量瓶中配制250mL烧碱溶液;
B.用碱式滴定管(或移液瓶移取)量取25mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂;
C.在天平上准确称取烧碱样品wg,在烧瓶中加蒸馏水溶解;
D.将物质的量浓度为mmol/L的标准硫酸溶液装入酸式滴定管,调整液面,记下开始刻度数V1mL;
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点耗酸体积V2mL。
回答下列问题:
(1)正确的操作步骤顺序是(填写字母)_______,_______,_______,D,_______。
(2)滴定管读数应注意____________________。
A.滴定管应垂直;
B.装液或放液后需等一会儿,待液面上下不发生变化时才能读数;
C.读数时目光不能俯视或仰视,视线应与液面最低点相平;
D.读数应读到0.01ml;
(3)操作中的锥形瓶下垫一张白纸的作用是______________________。
(4)操作D中液面应调整到_______________;尖嘴部分应__________________。
(5)滴定到终点时锥形瓶内溶液的pH约为__________;终点时溶液中指示剂的颜色变化是__________________。
(6)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响_________(填“偏高”“偏低”或“无影响”,其他操作均正确)
(7)该烧碱样品的纯度计算式是_____________________。
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 |
初始pH |
废水样品体积/mL |
草酸溶液体积/mL |
蒸馏水体积/mL |
| ① |
4 |
60 |
10 |
30 |
| ② |
5 |
60 |
10 |
30 |
| ③ |
5 |
60 |

测得实验①和②溶液中的Cr2O72—浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化的离子方程式为____________________
(3)实验①和②的结果表明________________;实验①中0~t1时间段反应速率v(Cr3+)=________________mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:____________________;
假设三:____________________;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O72—的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:
请根据题目要求回答下列问题:
(1)A的化学式为 。
(2)趁热过滤的目的是 。
(3)结晶操作过程中应控制滤液酸性的原因是 。
(4)实验室利用硫酸亚铁铵溶液[(NH4)2Fe(SO4)2]和草酸溶液反应生成草酸亚铁,草酸亚铁晶体(相对分子质量180)受热易分解,某课外小组设计如图的实验装置来检验其分解产物。
①该装置中最不合理的部分 (填字母),原因是 。
②改用正确装置开始实验,B处变蓝,说明草酸亚铁晶体中有 ;C处有白色沉淀,E处黑色粉末变为红色,说明草酸亚铁分解产生 (填化学式)。