(10分)信息时代产生的大量电子垃圾对环境构成严重威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含Cu、Fe及少量Au、Pt等金属的混合物,并用如下流程制备胆矾晶体(CuSO4•5H2O):
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Fe2+ |
Cu2+ |
| 开始沉淀 |
1.5 |
6.4 |
4.2 |
| 完全沉淀 |
3.2 |
8.9 |
6.7 |
(1)滤渣Ⅰ的主要成份是(写化学式)__________。
(2)反应Ⅱ中加入H2O2的作用是___________________。
(3)生成沉淀反应的离子方程式有______________________。
(4)操作Ⅰ的步骤是 、过滤、洗涤、干燥。
(5)测定胆矾晶体纯度的实验步骤如下:
A. 准确称取3.125g胆矾晶体样品配成100mL溶液;
B. 取10.00 mL溶液于带塞锥形瓶中,加适量水稀释,加入过量KI固体,发生反应:2Cu2+ +4Iˉ=2CuI↓ + I2
C. 继续向上述混合物中,逐滴加入0.1000 mol·L-1Na2S2O3溶液至恰好完全反应,共消耗12. 00mL Na2S2O3溶液:I2+2S2O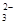 = 2Iˉ+S4O
= 2Iˉ+S4O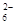 , 则样品中胆矾晶体的质量分数______。
, 则样品中胆矾晶体的质量分数______。
氯离子插层镁铝水滑石[Mg2Al(OH)6Cl·xH2O]是一种新型离子交换材料,其在高温下完全分解为MgO、Al2O3、HCl和水蒸气,冷却玻管B能降低气体的温度,但不能液化水蒸气。现用下图装置进行实验确定其化学式(固定装置略去)。
(1)Mg2Al(OH)6Cl·xH2O热分解的化学方程式为 。
(2)若只通过测定装置C、D的增重来确定x,则装置的连接顺序为 (按气流方向,用接口字母表示),其中C的作用是 。装置连接后,首先要进行的操作是 。
(3)加热前先通N2排尽装置中的空气,称取C、D的初始质量后,加热过程中持续通入N2的作用是 ,停止加热后的冷却过程中仍要持续通入N2的作用是_。
(4)完全分解后测得C增重3.65 g、D增重9.90 g,则x= 。若取消冷却玻管B后进行实验,测定的x值将 (填“偏高”或“偏低”)。
人体血液里Ca2+离子的浓度一般采用g/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得一种弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
【配制KMnO4标准溶液】下图是配制50mLKMnO4标准溶液的过程示意图。
(1)上述过程中有两处错误,请你观察图示判断其中不正确的操作是(填序号)____________;
(2)如果按照图示的操作配制溶液,所得的实验结果将____________(填偏大或偏小)。
【测定血液样品中Ca2+的浓度】抽取血样20.00mL,经过上述处理后得到草酸,再用酸化的0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(3)滴定时高锰酸钾需要酸化,从括号中选择酸化高锰酸钾溶液所用的酸(硫酸、盐酸、硝酸) ,确定反应达到终点的现象_____________________________。
(4)写出草酸跟酸性KMnO4溶液反应的离子方程式为: ;反应中若转移0.2mol 电子生成标准状况下CO2气体的体积为 L。
(5)根据所给数据计算血液样品中Ca2+离子的浓度为________mg/cm3。
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品。用图中的实验装置进行实验,证明过氧化钠可作供氧剂。
(1)A是利用盐酸和石灰石制取CO2的装置,A中发生反应的化学方程式为_____________.
(2)填写表中空格:
| 仪器 |
加入试剂 |
加入该试剂的目的 |
| B |
饱和NaHCO3溶液 |
|
| C |
||
| D |
(3)写出过氧化钠与二氧化碳反应的化学方程式:__________________。
在此反应中,过氧化钠的作用是_______(填序号) ①氧化剂;②还原剂;③既是氧化剂又是还原剂;④既不是氧化剂,又不是还原剂。
(4)试管F中收集满气体后,下一步实验操作是:___________________________。
为了保护环境,充分利用资源,某研究小组通过如图简化流程,将工业制硫酸的硫铁矿烧渣(含Fe2O3.SiO2.Al2O3等)转变成重要的工业原料FeSO4(反应条件略)
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O═15FeSO4+8H2SO4,不考虑其它反应,请回答下列问题:
(1)第1步H2SO4与Fe2O3反应的离子方程式是_____ _____.
(2)检验第II步中Fe3+是否完全还原,应选择__________(填字母编号).
| A.KMnO4溶液 | B.KSCN溶液 | C.KCl溶液 | D.KOH |
(3)第III步加FeCO3调溶液pH=6时,利用相关数据计算,(已知Ksp Al(OH)3=1.9×10﹣33,当离子浓度小于1×10﹣5mol•L﹣1时,可认为沉淀完全)判断Al3+_______(填“是”或“否”)能沉淀完全。
(4)FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:4Fe(s)+3O2(g)═2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是__________.
(5)FeSO4溶液在加热浓缩结晶时要注意_________________________________,FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2═Fe+2Li2S,正极反应式是__________.
环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮: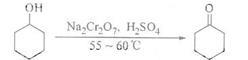
环己醇、环己酮和水的部分物理性质见下表:
| 物质 |
沸点(℃) |
密度(g-cm-3,200C) |
溶解性 |
| 环己醇 |
161.1(97.8)* |
0.9624 |
能溶于水 |
| 环己酮 |
155.6(95)* |
0.9478 |
微溶于水 |
| 水 |
100.0 |
0.9982 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应。反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为 。
②蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:
a蒸馏,收集151-156℃的馏分;b 过滤;c 在收集到的馏分中加NaCl固体至饱和,静置,分液;d 加入无水MgSO4固体,除去有机物中少量水。
①上述操作的正确顺序是 (填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需 。
③在上述操作c中,加入NaCl固体的作用是 。
(3)利用红外光谱图,可确定环己酮分子含官能团名称