室温时10 mL某气态烃与过量的氧气混合,完全燃烧后的产物通过浓硫酸,再恢复到至室温,气体体积减少了35 mL ,剩余气体再通过氢氧化钠溶液,体积又减少了40 mL 。求气态烃的分子式并写出该分子式的同分异构体。
食品安全是社会关注的热点。市场上已检测出一些矿泉水中含有高浓度的致癌物“溴酸盐”,而这个“行业秘密”在人们的眼皮底下被隐藏了10多年。实验室中制备“溴酸盐”过程如下: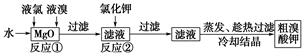
根据上述转化关系回答下列问题:
(1)反应①的化学方程式为______________________________。
(2)已知反应②是复分解反应,该反应的化学方程式为_____________________________。
(3)已知在酸性条件下溴酸盐可发生如下离子反应:
Ⅰ.2BrO3-+10Cl-+12H+=5Cl2↑+Br2+6H2O
Ⅱ.6BrO3-+5Cl-+6H+=5ClO3-+3Br2+3H2O
Ⅲ.BrO3-+5Br-+6H+=3Br2+3H2O
①上述反应所涉及的粒子中,氧化性最强的是________。
②在KCl和KBr的酸性混合溶液中,加入过量的KBrO3,其氧化产物为________,还原产物为________。
③将12 mL 0.4 mol·L-1 KBrO3溶液和10 mL 0.6 mol·L-1 KCl溶液在稀H2SO4中混合,充分反应后,产物KClO3和Cl2的物质的量之比为________。
食盐和工业用盐具有广泛的用途。已知工业用盐主要成分为NaNO2,外观酷似食盐并有咸味。NaNO2有氧化性和还原性,遇酸分解放出NO2。
(1)下列试剂可鉴别工业用盐和食盐的是________。
a.H2O b.硝酸酸化的硝酸银 c.盐酸
(2)NaNO2与氢碘酸反应(含氮产物为NO)的离子方程式为______________。
(3)某工厂废液中含有2%~5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2中的氮转化为对空气无污染的气体,该物质是________。
a.NaCl b.NH4Cl c.浓H2SO4
(4)氯碱工业通过电解饱和食盐水来获得相应的产物。请写出电解食盐水的离子方程式______________________________________,
若在标准状况下生成3.36 L H2,则溶液中生成的OH-的物质的量为____。
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
提示:4FeS2+11O2高温,2Fe2O3+8SO2
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第________周期________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为________。
(3)在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是________(填序号)。
(4)反应④的离子方程式是_____________________________________。
(5)将化合物D与KNO3、KOH共熔,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是________________________。
加兰他敏是目前用于治疗老年性痴呆的药物之一。下面是它的一种合成路线(Ph表示C6H5—):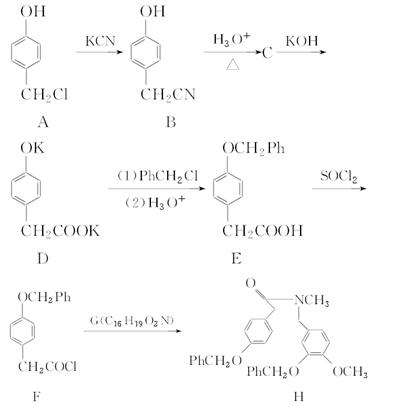
→……→
I(加兰他敏)
(1)化合物B的分子式是________。
(2)A→B的反应类型是________,A分子中含有的官能团为_____(填官能团名称)。
(3)G的结构简式是__________________。
(4)写出C与NaHCO3溶液反应的化学方程式为_________________。
(5)下列关于E的说法正确的是________。
a.能使酸性KMnO4溶液褪色
b.能与Na2CO3溶液反应
c.能与FeCl3溶液发生显色反应
d.1 mol E完全燃烧消耗17 mol O2
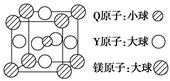
Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| Q |
Q的单质是实验室常用的惰性电极材料 |
| R |
R原子基态时2p原子轨道上有3个未成对电子 |
| T |
负二价的元素T的氢化物在通常状况下是一种液体,且其中T的质量分数为88.9% |
| X |
X是第三周期电负性最大的元素 |
| Y |
元素Y位于周期表的第10列 |
| Z |
Z存在质量数为65,中子数为36的核素 |
(1)Z元素的原子基态时的电子排布式是________。
(2)下列叙述正确的是________(填字母序号)。
a.Q的气态氢化物比R的气态氢化物稳定
b.Q的含氧酸一定比R的含氧酸酸性强
c.R的气态氢化物的熔点在同族元素的氢化物中最低
d.R的第一电离能、电负性都比Q的大
(3)Q和T可形成两种常见化合物,分别表示为QT和QT2。QT分子中σ键和π键的个数比为________;QT2分子中,Q原子采取________杂化。
(4)笑气(R2T)是一种麻醉剂,有关理论认为R2T与QT2分子具有相似的结构。故R2T的空间构型是________,其为________(填“极性”或“非极性”)分子。
(5)含有Q、Y和镁三种元素的某种晶体具有超导性,其结构如图所示。则该晶体的化学式为________;晶体中每个镁原子周围距离相等且最近的Y原子有______个。