元素X的原子核外M电子层上有3个电子,元素Y的原子得到2个电子后形成的离子核外有18个电子,则这两种元素可形成的化合物为
| A.XY2 | B.XY | C.X3Y2 | D.X2Y3 |
由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为
| A.29:8:13 | B.22:l:14 | C.13:8:29 | D.26:16:57 |
V mL Al2(SO4)3溶液中含Al3+a g,取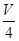 mL溶液稀释到4 V mL,则稀释后溶液中SO
mL溶液稀释到4 V mL,则稀释后溶液中SO 的物质的量浓度是( )
的物质的量浓度是( )
A.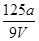 mol·L-1 mol·L-1 |
B. mol·L-1 mol·L-1 |
C.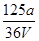 mol·L-1 mol·L-1 |
D. mol·L mol·L |
下列配制1.0mol/L的NaOH溶液的操作不会造成误差的是
| A.称量后转移固体时不小心把少量固体洒到烧杯外 |
| B.干净的容量瓶又用蒸馏水洗涤了一遍 |
| C.转移过程中不小心把几滴溶液滴在外面 |
| D.加水定容时,加水过多,倒出后并恢复到刻度线水平 |
300mL某浓度的NaOH溶液中含有60g溶质。现欲配制1mol·L-1NaOH溶液,应取原溶液与蒸馏水的体积比约为
| A.1∶4 | B.1∶5 | C.2∶1 | D.2∶3 |
在标准状况下,将wg A气体(摩尔质量为Mg/mol)溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为
A.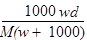 |
B.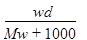 |
C.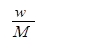 |
D.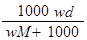 |