请仔细阅读以下转化关系:
已知:(Ⅰ) 烃类化合物A的质谱图表明其相对分子质量为84;红外光谱表明其分子中含有碳碳双键;核磁共振氢谱显示其分子中只有一种氢原子。
(Ⅱ) D1、D2互为同分异构体,E1、E2互为同分异构体。
(Ⅲ)共轭二烯烃1,2加成:CH2=CH-CH=CH2 +Br2 CH2Br-CHBr-CH=CH2
CH2Br-CHBr-CH=CH2
共轭二烯烃1,4加成:CH2=CH-CH=CH2 +Br2 CH2Br-CH=CH-CH2Br
CH2Br-CH=CH-CH2Br
请回答:
(1)A的结构简式为______________________。
A分子中的碳原子是否都处于同一平面?___________(填“是”或“不是”)。
(2)写出反应②的化学方程式: __________________________________________。
(3)写出下列反应的反应类型:反应①__________、反应②________、反应⑥__________。
(4)写出E1的结构简式并用系统命名法给C命名:
E1____________________________,C的名称:_____________________________。
(5)化合物F是A的同系物,相对分子质量为56,写出F所有可能的结构:
______________________________________________________________________。 (6)写出在加热和浓硫酸作用下,E2与足量 反应的化学方程式:
(6)写出在加热和浓硫酸作用下,E2与足量 反应的化学方程式:
_______________________________________________________________________。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是 ,该工艺中“搅拌”的作用是 。
(2)反应Ⅱ中的离子方程式为 ,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是 。(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如下:
| 装置 |
序号 |
试管中的药品 |
现象 |
持续通入 |
实验Ⅰ |
1.5 mL 1 mol·L-1CuSO4溶液和3.5 mL 1 mol·L-1NaOH溶液混合 |
开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
实验Ⅱ |
1.5 mL 1 mol·L-1CuCl2溶液和3.5 mL 1 mol·L-1NaOH溶液混合 |
开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
(1)制取新制Cu(OH)2悬浊液的离子方程式为 。
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净。向洗净后的Cu(OH)2中加入5 mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明: 。检验Cu(OH)2洗涤干净的方法是 。
(3)同学们对白色沉淀的成分继续进行探究。查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸。它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液。
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl + 2NH3·H2O = Cu(NH3)2+ +Cl- + 2H2O 、 ____________ 。
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如下: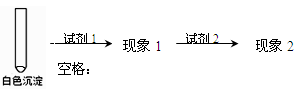
填写下表空格:
| 试剂1 |
试剂2 |
蒸馏水 |
|
| 现象1 |
现象2 |
③写出实验II中由Cu(OH)2生成白色沉淀的离子方程式: 。
(4)丙同学通过实验证明实验Ⅰ中观察到的砖红色沉淀是Cu2O。完成合理的实验方案:取少量Cu2O固体于试管中, _______________ ,则说明砖红色沉淀是Cu2O。
索氏制碱又称氨碱法,其主要生产流程如右图: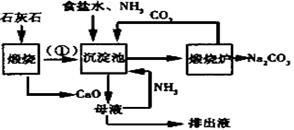
36.用化学方程式表示沉淀池中发生的反应 ,排出液的主要成分是 。
氨碱法制得的纯碱样品中可能会含有杂质(如NaCl)。现用两个实验方案测定纯碱样品的纯度。
方案1气体法 :称取样品m克装入Y型试管左侧(如右图)
37.Y型试管另一端应装入试剂为 ,量气管中液体应为 。若最后读数时,发现水准管液面高于量气管(其他操作都正确),则计算所得纯碱样品的纯度值 (填“偏大”、“偏小”或“无影响”)。
方案2滴定法:
已知: 25℃时0.1 mol/L的NaHCO3溶液的pH约为8.3
0.1mol/L的Na2CO3 溶液的pH约为11.6
38.指示剂选用酚酞,则该纯碱样品的纯度为 。(请用所给数据的字母符号表示)
氨碱法中钠利用率不高,一些化工专家开始研究有机胺制碱法,其工艺流程如下: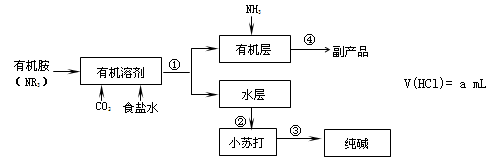
已知: NR3+ HCl →NR3·HCl,且NR3·HCl易溶于有机溶剂
NR3·HCl+NH3→NR3 +NH4Cl
39.有机胺制碱法反应生成小苏打的化学方程式是 , 操作①是 。
40.副产品的成分是 ,本工艺流程中可循环利用的物质是 。
亚硫酸钠和硫粉通过化合反应可制得硫代硫酸钠(Na2S2O3)。
已知:Na2S2O3在酸性溶液中不能稳定存在。有关物质的溶解度随温度变化曲线如右下图所示。某研究小组设计了制备Na2S2O3·5H2O的如下装置图 。

部分操作步骤如下:
①打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
②C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
当C中溶液的pH接近7时,即停止C中的反应,停止加热
③过滤C中的混合液,并将滤液进行处理,得到产品。
31.步骤①中,圆底烧瓶中发生反应的化学方程式是 。
32.步骤②中,“当C中溶液的pH接近7时即停止C中的反应”的原因是 。“停止C中的反应”的操作是 。
33.步骤③中,“过滤”用到的玻璃仪器是烧杯、 、 (填仪器名称)。将滤液进行处理过程是将滤液经过 、 、过滤、洗涤、烘干,得到产品。
依据反应2S2O32- + I2 → S4O62- + 2I-,可用I2的标准溶液测定产品的纯度。取5.5g产品配制成100mL溶液。取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050 mol/L I2的标准溶液进行滴定,相关数据记录如下表所示。
| 编号 |
1 |
2 |
3 |
4 |
| 溶液的体积/mL |
10.00 |
10.00 |
10.00 |
10.00 |
| 消耗I2标准溶液的体积/mL |
19.99 |
19.98 |
17.13 |
20.03 |
34.判断达到滴定终点的现象是 。
35.Na2S2O3·5H2O在产品中的质量分数是 。(计算结果请用百分数表示并保留1位小数)(Na2S2O3·5H2O的式量为248)
亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及生成气体产物的成分。已知:①NO+NO2+2OH-=2NO2-+2H2O
②气体液化的温度:NO2 21℃、NO-152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→C→_______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体.
①确认A中产生气体含有NO,依据的现象是___________________
②装置E的作用是______________________
(3)如果向D中通入过量O2,则装置B中发生反应的化学方程式为________________.
如果没有装置C,对实验结论造成的影响是______________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
则CH4将NO2还原为NO的热化学方程式为:____________________。