某待测溶液(阳离子为Na+)中只可能含有 、
、 、Cl-、Br-、
、Cl-、Br-、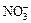 、
、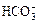 中的一种或若干种,进行下列实验(每次实验所加试剂均足量):
中的一种或若干种,进行下列实验(每次实验所加试剂均足量):
回答下列问题: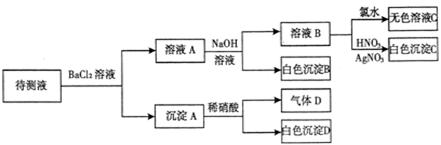
(1)待测液中是否含 、
、 离子
离子
(2)气体D的化学式为 ,反应生成沉淀B的离子方程式为:
(3)根据以上实验,待测液中肯定没有的离子 ;肯定存在的离子是 。
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱 ”指烧碱和纯碱。
”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是___________ 。
(2)“三酸”与“两碱”之间均可反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式(酸过量时)。
__________________________________;
。
现有 H2、CaCO3、HCl、NH3这组物质,请你从组成的元素、物质的性质等多个角度用两种不同的分类标准,从这组中选出一种不同类的物质,并指出其分类标准,写在下面相应的表格内。
| 分类标准 |
不属于该类别的物质 |
| 分类标准一: |
|
| 分类标准二: |
在Cu+2H2SO4(浓) CuSO4 +SO2↑+2H2O 反应中,
CuSO4 +SO2↑+2H2O 反应中, 是氧化剂,还原剂是,元素被氧化,是还原产物,电子转移的总数为。
是氧化剂,还原剂是,元素被氧化,是还原产物,电子转移的总数为。
有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。请回答下列问题:
(1)E的化学式是_________________________
(2)反应①的离子方程式为
(3)写出另外一种实验室制取H的化学方程式
(4)反应②的化学方程式为
将Cu投入足量的FeCl3的水溶液中,两者发生反应的化学方程式如下
2FeCl3+Cu= 2FeCl2+CuCl2
(1)请用双线桥法标出电子转移的方向和数目。
(2)在该反应中,氧化剂是___________,氧化产物是___________。
(3)当有0.3mol电子发生转移时,发生反应的Cu的质量为___________g。
(4)请将以上反应改写为离子方程式_______________________________。