Ⅰ.甲同学利用下列装置验证木炭与浓硫酸反应的全部产物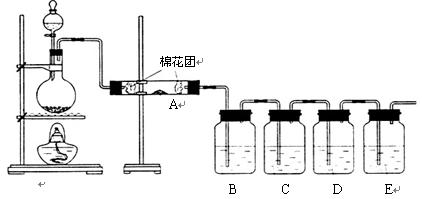
(1)写出木炭与浓硫酸反应的化学方程式:
(2)A中加入的试剂是 ,B、D中加入的试剂都是品红溶液,D中正确的实验现象是:
(3)实验时,C中若加入的是滴有淀粉的碘水,观察到的现象是 ,
离子方程式为: 。
Ⅱ.乙同学只用B、C、D、E装置验证SO2的某些性质,请回答下列问题:
(1)C中加入的试剂是 ,证明SO2具有氧化性。
(2)D中加入酸性的KMnO4溶液,证明SO2具有 性。
(3)E中加入滴有酚酞的NaOH溶液,证明SO2是 性气体。
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: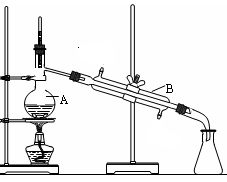
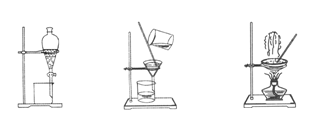
图1图2图3图4
(1)装置图1中A的名称是________,B的名称是。A 中一般要加入碎瓷片,其作用是。装置图4中盛溶液的仪器名称是。
(2)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: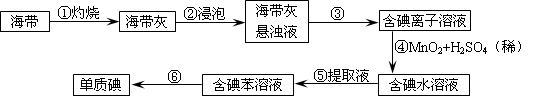
1)灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________(从下列仪器中选出所需仪器,用标号字母填写在空白处);
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 E.酒精灯 F.干燥器 |
2)步骤③的实验选择上述装置图(填图的序号)。步骤⑤的实验操作名称是________,
选择上述装置图(填图的序号)。步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是________,选择上述装置图(填图的序号)
某化学兴趣小组的同学通过以下步骤提取海带中的碘:
①将海带晒干灼烧成灰②将海带灰浸泡得其悬浊液③过滤得含碘离子的溶液④向该溶液中加入适量Cl2置换出碘⑤对含碘溶液进行一系列的提取后得碘单质
(1)灼烧过程可在下列那种仪器中进行_____________
| A.烧杯 | B.试管 | C.蒸发皿 | D.坩埚 |
(2)过滤用到的三种玻璃仪器主要
(3)用有机溶剂将碘从水中提取出来需用到下列哪套装置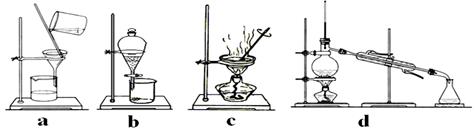
(4)若用四氯化碳作溶剂进行提取,则分层后下层物质为
实验室制备苯乙酮的化学方程式为: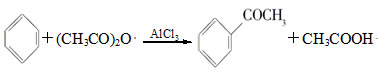
制备过程中还有CH3COOH+AlCl3―→CH3COOAlCl2+HCl↑等副反应。
主要实验装置和步骤如下: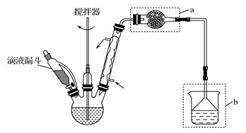
(Ⅰ)合成:在三颈瓶中加入20g无水三氯化铝和30mL
无水苯。为避免反应液升温过快,边搅拌边慢慢滴加6mL
乙酸酐和10mL无水苯的混合液,控制滴加速率,使反应液
缓缓回流。滴加完毕后加热回流1小时。
(Ⅱ)分离与提纯:①边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,分离得到有机层②水层用苯萃取,分液③将①②所得有机层合并,洗涤、干燥、蒸去苯,得到苯乙酮粗产品④蒸馏粗产品得到苯乙酮
回答下列问题:(1)仪器a的名称:________;装置b的作用:________。
(2)合成过程中要求无水操作,理由是_______________________。
(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致________。
| A.反应太剧烈 | B.液体太多搅不动 | C.反应变缓慢 | D.副产物增多 |
(4)分离与提纯操作②的目的是________。该操作中是否可改用乙醇萃取?________(填“是”或“否”),原因是______________________。
(5)分液漏斗使用前须________并洗净备用。萃取时,先后加入待萃取液和萃取剂,经振摇并________后,将分液漏斗置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先________,然后打开活塞放出下层液体,上层液体从上口倒出。
(6)粗产品蒸馏提纯时,下列装置中温度计位置正确的是________,可能会导致收集到的产品中混有低沸点杂质的装置是________。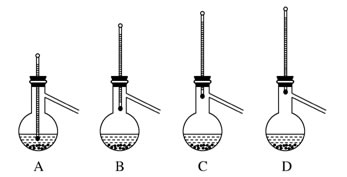
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。现利用图10所示装置进行实验。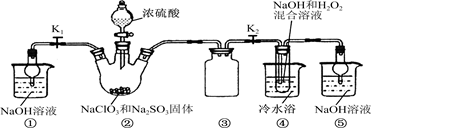
(1)装置③的作用是____________________。
⑵装置②中产生ClO2的化学方程式为____;
装置④中制备NaClO2的化学方程式为____。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55 ℃蒸发结晶;②趁热过滤;③____________;④低于60 ℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
⑷达到滴定终点时的现象为________________。
⑸该样品中NaClO2的质量分数为____________(用含m、c、V的代数式表示)。
⑹在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为________________。
镁在高温下与O2、N2或CO2均可以发生反应,试解决下列问题。
(1)工业通常采用电解熔融氯化镁冶炼金属镁,不以氧化镁为原料的理由是。
(2)将燃着的镁条伸入盛满CO2的集气瓶中,镁条剧烈燃烧,发出耀眼的白光,瓶内壁上有黑色物质生成,化学方程式为。
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的反应步骤为
金属镁的作用为,在Ar气氛中的进行的理由是。
(4)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知:
Mg+H2O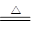 MgO+H2↑Mg3N2 +6H2O =3Mg(OH)2+2NH3↑
MgO+H2↑Mg3N2 +6H2O =3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示。

①导管口间的连接次序是:a →( )()→()()→()()→ h
②通气后,应先点燃(填“B”或“C”)装置的酒精灯,装置A的作用是,装置E的作用是。
③请设计一个简单的小实验验证产物是氮化镁。