将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示: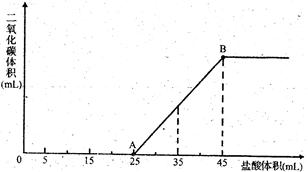
(1)写出OA段所发生反应的离子方程式: ;
(2)当加入35mL盐酸时,产生二氧化碳的体积为 mL(标准状况);
(3)原混合物中Na2CO3的质量分数为 。
在2L密闭容器中,充入1 mol N2和3mol H2,一定条件下发生合成氨反应,2min时达到平衡。测得平衡时N2的转化率为40%,求:
(1)平衡时v (NH3)的速率
(2)求该温度下的平衡常数K(列出算式,不用计算出结果)
(3)H2在平衡混合气体中的体积分数
(4)平衡时容器的压强与起始时压强之比
(1)在Al2(SO4)3溶液中,含Al3+ 为mg,则该溶液中SO42-的物质的量浓度为 mol•L-1。
(2)在标准状况下,6.72L CH4和CO的混合气体的质量为6g,该混合气体中有 mol CH4, mol CO。
(3)某物质A加热时按下式分解:2A═2B+C+3D(产物均为气体),现测得由生成物组成的混合物气体对H2的相对密度为23,则反应物A的摩尔质量为 g/mol。
计算题两瓶不同浓度的氢氧化钠溶液各取100ml,分别通入CO2 2.24L(标准状况)。完全反应后,将溶液低温缓慢蒸干,分别得到不含结晶水的固体10.0g、11.6g,判断这两种固体的组成成分,并计算原两瓶氢氧化钠溶液的物质的量浓度各是多少?
取一定量Na2CO3和Na2SO4的混合物溶液分成两等份,一份与过量盐酸反应,生成2.016 L CO2(标准状况下),另一份加入足量的Ba(OH)2溶液,得到沉淀的质量为20.06 g。试计算原混合物中Na2CO3和Na2SO4的物质的量分别为多少?(写计算过程)
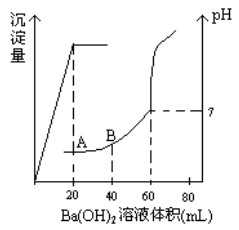
有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25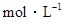 氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示。求:
氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示。求:
(1)滴定前盐酸和硫酸的物质的量浓度各为多少?
(2)在B点时的pH是多少?(已知lg2=0.3)(无计算过程不得分)