(共计12分)
A.锌是一种重要的金属,锌及其化合物有着广泛的应用。
(1)葡萄糖酸锌[CH2OH(CHOH4COO)2Zn是目前市场上流行的补锌剂。写出Zn2+基
态电子排布式 ;葡萄糖[CH2OH(CHOH)4CHO]分子中碳原子杂化方式是 。
(2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子空间构型为 ;
在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在下图中
表示[Zn(NH3)4]2+中Zn2+与N之间的化学键 。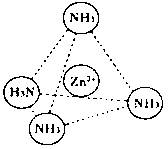
(3)下图表示锌与某种元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;
该化合物的晶体熔点比干冰高得多,原因是 。
(能力提高)实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠的氯化钠。某学生设计了如下方案: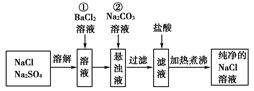
如果此方案正确,那么:
(1)操作①是否可改为加硝酸钡溶液?为什么?
(2)进行操作①后,如何判断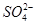 已除尽,方法是__________________________。
已除尽,方法是__________________________。
(3)操作②的目的是________,为什么不先过滤后再加碳酸钠溶液?理由是________________________________________________________________________。
A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)24种溶液中的一种,现利用另一种溶液X,用如图所示方法可将它们依次确定。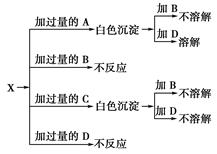
试确定A、B、C、D、X各代表哪种溶液。
A________,B________,C________,D________,X________。
A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是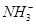 、
、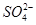 、Cl-、
、Cl-、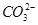 中的某一种。
中的某一种。
(1)若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
(2)若向(1)的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出。
根据(1)、(2)实验事实可推断它们的化学式为:
A________、B________、C________、D________。
某河道两旁有甲、乙两厂,它们排放的工业废水中含有K+、Ag+、Fe3+、Cl-、OH-、 六种离子,甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、________、__________。
六种离子,甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、________、__________。
乙厂的废水中含有另外三种离子,如果加一定量________(填“活性炭”“硫酸亚铁”或“铁粉”),可以回收其中的金属________(填元素符号)。
另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的________________转为沉淀,经过滤后的废水主要含________,可用来浇灌农田。
配制l mol/L的Na2CO3溶液200 mL,需要Na2CO3·10H2O_________g,取该溶液50 mL加水稀释至500 mL,稀释后溶液的物质的量浓度为__________ 。