某河道两旁有甲、乙两厂,它们排放的工业废水中含有K+、Ag+、Fe3+、Cl-、OH-、 六种离子,甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、________、__________。
六种离子,甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、________、__________。
乙厂的废水中含有另外三种离子,如果加一定量________(填“活性炭”“硫酸亚铁”或“铁粉”),可以回收其中的金属________(填元素符号)。
另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的________________转为沉淀,经过滤后的废水主要含________,可用来浇灌农田。
为了达到下列表格中的实验要求,请从供选择的化学试剂中选出合适的试剂,将其标号填入对应的空格中。
下图中A~G均为中学化学中常见的物质,它们之间有如下转化关系。常温下,A为紫红色金属固体,B为常见的强酸,G为地壳中含量最多元素组成的气态单质;D、F都是大气污染物,主要来源于汽车尾气,D为无色气体,F为红棕色气体。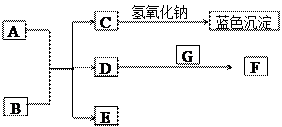
请回答以下问题:
①D的化学式是;C+NaOH生成的蓝色沉淀是(填化学式);
②构成G单质的元素在元素周期表中的位置为;
③写出B的稀溶液与A反应的化学方程式:。
下面是元素周期表的一部分,表中的每个字母表示一种短周期元素,请回答下列问题:
| A |
||||||||
| B |
C |
D |
E |
(1)D的最高价氧化物对应的水化物的化学式是__________。
(2)A、E两种元素中非金属较强的是___________(填元素符号)。
(3)B、C两元素的原子半径较小的是___________(填元素符号)。
(4)在盛有水的小烧杯中加入元素B的单质,发生反应的化学方程式为:
_________________________________________________________________________。
请根据题意选择下列物质:
| A.CH3COOH, | B.CH3CH2OH, | C.NaHCO3, | D.Na2O2,并用其字母代号填空: |
(l)能和碳酸钠反应生成二氧化碳的是;
(2)常用作为潜水艇呼吸面具中氧气来源的是;
(3)常用作溶剂,也可用作汽油替代燃料的是。
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成。乙醇和汽油经加工处理形成的车用燃料即乙醇汽油。
结合有关知识,回答下列问题:
(1)乙醇分子中的官能团是(填写名称)。
(2)试写出实验室用乙酸和乙醇在浓硫酸催化作用下共热反应生成乙酸乙酯的化学方程式 。