请选择合适方法的字母代号填空
(1)从煤焦油中提取二甲苯 (2)从海水中提取粗盐
(3)丁烷转变为乙烷和乙烯 (4)从铁矿石中提取金属铁
(5)煤转化为焦炭、煤焦油等
(6)提纯氢氧化铁胶体(除去其中的杂质离子)
| A.过滤 | B.裂解 | C.分馏 | D.裂化 E、干馏 F、还原 G、电解 H、渗析 |
I、蒸发 J、氧化
在通常状况下,NO2和SO2很容易发生反应生成NO和SO3,该反应为不可逆反应。现将NO和SO2的混合气体通入容积为100 mL的容器中,充满后,用带有导管的塞子密封。
(1)向容器中通入O2的体积,x在 数值范围内才能保持容器内的压强不变。
(2)要使容器内只含有NO2和SO3两种气体,必须通入O2 mL。
(3)若向容器中通入40 mL O2后才开始出现红棕色,且不褪色,则原混合气体中NO的体积为 mL(气体体积均在同温、同压下测定,此时SO3为气体,且不考虑2NO2 N2O4的反应)。
N2O4的反应)。
在新疆与青海两省区交界处有一狭长山谷,每当牧民和牲畜进入后,风和日丽的晴天顷刻电闪雷鸣,狂风大作,人畜常遭雷击而倒毙。奇怪的是这里牧草茂盛,四季常青,被当地牧民称为“魔鬼谷”。用化学方程式表示“魔鬼谷”牧草茂盛,四季常青的原因。
A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态。其中D能分别跟A、B、C在一定条件下两两化合,生成化合物X、Y、Z;A与B、C均不能直接化合。有关的转化关系如下图所示(反应条件均已略去)。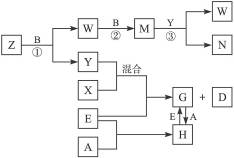
完成下列问题:
(1)Z分子的空间构型为_________。
(2)反应③中被氧化的物质与被还原物质的物质的量之比为_________。
(3)Z和W在催化剂作用下,反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为___________________________。
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023个,则参加反应的E的质量为_________g。
(5)将Z与N反应后的产物溶于水中,则溶液的pH_________(填“<”或“>”)7,其原因是(用离子方程式表示)_________________。
NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体的许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学研究的热点,NO亦被称为“明星分子”。请完成下列问题。
(1)NO对环境的危害在于____________(填以下项目的编号)。
| A.破坏臭氧层 | B.高温下能使一些金属被氧化 |
| C.造成酸雨 | D.与人体血红蛋白结合 |
(2)在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式_____________________________________________________。
(3)在常温下,把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50 ℃,发现气体的压力迅速下降,压力降至略小于原压力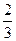 就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式_______________________________________________________。
就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式_______________________________________________________。
“神舟”5号宇宙飞船是靠长征Ⅱ(F)型运载火箭发射升空的。该火箭所用的燃料是偏二甲肼〔(CH3)2N—NH2〕,氧化剂是N2O4,产物是氮气、二氧化碳和水。
(1)火箭点火瞬间,逸出的红棕色气体是_______,产生该气体的化学反应方程式为_________。
(2)偏二甲肼在N2O4中燃烧的化学方程式为_________________________,当有1 mol偏二甲肼燃烧时,转移电子的物质的量为___________。