以下是某实验小组用工业硫酸铜(含硫酸亚铁等杂质)进行提纯实验,得到纯净硫酸铜晶体的流程:(已知数据:lg2=0.3;lg5=0.7)
请回答下列问题:
(1)①步骤I的目的是除不溶性杂质。操作是 。
②步骤Ⅱ是为了除去Fe2+,常加入氧化剂使Fe2+氧化为Fe3+,下列物质最适合的是________。
A.KMnO4 B.H2O2 C.Cl2水 D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A.NaOH B.NH3·H2O C.CuO D.Cu
(2)已知常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,分别写出Cu(OH)2开始沉淀时溶液的pH=________并写出步骤Ⅱ调节溶液pH的合理范围______。
按下列要求填空
(1)右面六组物质:(填序号)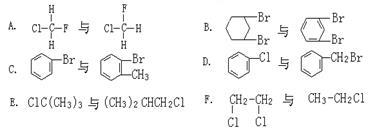
属于同系物的是_______________________
属于同分异构体是_____________________
属于同种物质的是_____________________
(2)按要求完成下列问题:
①某高分子有机物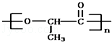 是由一种单体脱水缩聚而成的,该单体的键线式为____________
是由一种单体脱水缩聚而成的,该单体的键线式为____________
②将少量水杨酸( )滴入Na2CO3溶液中,生成的有机物的结构简式是:____________
)滴入Na2CO3溶液中,生成的有机物的结构简式是:____________
③CH2ClCOOCH2CH3与NaOH的水溶液共热的方程式:__________________
④有机物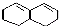 在较高温度下和Br2按物质的量之比1:1发生1,4-加成反应的化学方程式
在较高温度下和Br2按物质的量之比1:1发生1,4-加成反应的化学方程式
有关海洋中部分资源的利用如下图所示,回答下列问题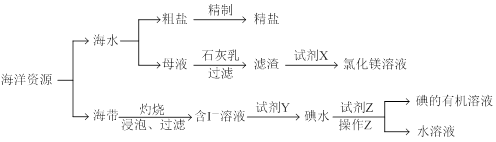
(1)粗盐中除含有泥砂等不溶性杂质外,还含有Ca2+、Mg2+、SO42-等杂质离子。
①除去杂质离子所用试剂按顺序依次是 、 、 (填试剂的化学式),过滤后向滤液中加入适量盐酸,蒸发结晶得精盐。
②检验所得精盐中是否含有SO42-的操作是 。
(2)母液中含有较多的Mg2+,利用流程所示方法可以制取氯化镁溶液,滤渣中加入试剂X的化学方程式为 。
(3)含I-溶液中加入试剂Y的目的是 。
(4)试剂Z可以用_____________,操作Z的名称是 ,所需主要玻璃仪器的名称是 。
实验室可以用KMnO4固体和浓盐酸反应制取少量Cl2,反应的化学方程式为:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
回答下列问题:
(1)该反应中的氧化剂是 ,被氧化的元素是 。
(2)该反应中氧化剂和还原剂的物质的量之比为 。
(3)氧化性:KMnO4 Cl2(填“>”、“<”或“=”)
(4)用单线桥法表示该反应中电子转移的方向和数目:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(5)每生成标准状况下1.12L Cl2,反应中转移电子的物质的量为 。
按要求完成下列填空:
(1)已知在标准状况下的四种气体①6.72LCH4;②3.01×1023个HCl分子;③13.6克H2S;④0.2molNH3 用相应的序号填写下列空白:
体积最大的是 ;质量最小的是 ;含氢原子数最多的是 。
(2)等物质的量的氧气与臭氧质量之比为 , 分子个数之比为__________,氧原子个数之比为_____________。
(3)某金属氯化物MCl3 26.7 g,含有0.600mol Cl-。则金属M的摩尔质量为__________。
(4)现有10克由2H和16O组成的水分子,其中含质子数为___________mol, 中子数为___________mol 。
实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应:2A(g)+B(g) 2C(g);△H =QkJ/mol
2C(g);△H =QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
| 实验 序号 |
 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
8 0 0 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
8 0 0 ℃ |
n2 |
0.60 |
0. 50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
8 0 0 ℃ |
n3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
7 3 0 ℃ |
1.0 |
0.90 |
0.80 |
0.75 |
0.70 |
0.65 |
0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc= 实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q 0(填“>、=、<”),
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是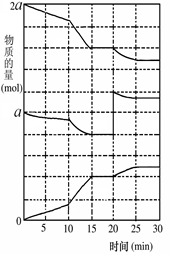
a.10~15 min可能是升高了温度
b.10~15 min可能是加入了催化剂
c.20 min时可能缩小了容器体积
d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA (g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的 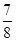 。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的
。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的 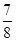 。
。
①a、b、c必须满足的关系是 (一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是