为讲授“氯气的性质和用途”,某老师利用二氧化锰和浓盐酸为主要原料,设计一套如图所示的实验装置(其中A是连有注射器针头的 橡皮管,针头已插入并穿过橡皮塞)进行教学。试回答下列问题:
橡皮管,针头已插入并穿过橡皮塞)进行教学。试回答下列问题:
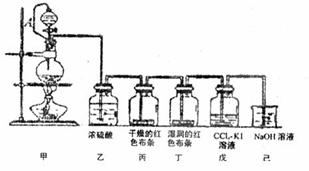
(1)甲中烧瓶发生反应的化学方程式为 。
(2)丙中的现象是 ;
己中的离子方程式:______________________________;。
(3)利用橡皮管将分液漏斗上端与烧瓶连通,其作用是 。
(4)已知氯气与冷水反应的化学方程为Cl2 + H20 =" HCl" + HClO。
①你认为使有色布条褪色的物质是 。
②为探究其生成物的漂白性,请设计简单的实验加以证明,写出实验的操作方法、现象和结论
水果成熟时,大多数香气袭人。乙酸丁酯(CH3COOCH2CH2CH2CH3)是具有果香味的香精,经酯化反应可进行乙酸丁酯的合成。有关物质的物理性质见右表。合成过程如下:第一步:将丁醇和x的混合液和过量的乙酸混合加热发生酯化反应;第二步:洗涤提纯;第三步:蒸馏提纯。
| 乙酸 |
1-丁醇 |
乙酸丁酯 |
|
| 熔点/℃ |
16.6 |
-89.5 |
-73.5 |
| 沸点/℃ |
117.9 |
117 |
126.3 |
| 密度/g·cm-3 |
1.05 |
0.81 |
0.88 |
| 水溶性 |
互溶 |
互溶 |
不溶 |

(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)C→F→→→→。
(2)C装置中除了装有1-丁醇和过量的乙酸外,还装有___________、_________。装置C中冷凝管的作用是:;
(3)乙酸过量的原因是________________。
(4)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是_____ ___ _
(5)步骤E的操作要领是:①用一只手的手掌压住分液漏斗的塞子并握住分液漏斗;②另一只手握住活塞部分;③。
(6)要除去乙酸丁酯中含有的少量乙酸,下列试剂中可选用的是:
A. 饱和NaOH溶液 B. 饱和KHCO3溶液
C.饱和Na2CO3溶液D. 饱和 K2CO3溶液
E. 饱和KOH溶液F.过量的 1-丁醇
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
⑴装置中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
⑵该反应属于哪类反应类型。
A加成反应 B取代反应C水解反应 D酯化反应E可逆反应
⑶酯化反应的断键特点是:
⑷写出制取乙酸乙酯的化学反应方程式:
⑸为了证明浓硫酸的作用,某同学进行了以下4个实验。实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡小试管Ⅱ再测有机物的厚度,实验记录如表:
| 实验编号 |
试管Ⅰ中试剂 |
试管Ⅱ中试剂 |
有机层厚度/cm |
| A |
3 mL乙醇、2 mL乙酸、1 mL 18 mol/L浓硫酸 |
饱和Na2CO3溶液 |
5.0 |
| B |
3 mL乙醇、2 mL乙酸 |
饱和Na2CO3溶液 |
0.1 |
| C |
3 mL乙醇、2 mL乙酸、6 mL 3 mol/L硫酸 |
饱和Na2CO3溶液 |
1.2 |
| D |
3 mL乙醇、2 mL乙酸、一定浓度的盐酸 |
饱和Na2CO3溶液 |
1.2 |
实验D的目的是与实验C对照,证明H+对该反应的催化作用。实验D中加入盐酸的体积和浓度分别是mL和mol/L。
已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。
阅读下列实验内容,根据题目要求回答问题:
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14 mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14 mol·L-1NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。 |
| B.用待测定的溶液润洗酸式滴定管。 |
| C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。 |
E、检查滴定管是否漏水。
F、另取锥形瓶,再重复操作一次。
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)___________________________ 。
②该滴定操作中应选用的指示剂是 ____________。
③在G操作中如何确定终点? __________________________ ____。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果______________(填“偏小”、“偏大”或“无影响”)。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是 ___________。
(4)如有1 mol·L-1和0.1 mol·L-1的NaOH溶液,应用________________ _的NaOH溶液,原因是__________________________ __________________________。
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入__(选填“甲”或“乙”)中。
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值(选填“偏大”“偏小”或“无影响”)
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果保留到小数点后第二位) ___。
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯: CH3CH2OH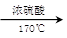 CH2=CH2↑+H2O,加热一段时间后溶液中有黑色现象出现。过一段时间后,经硫酸酸化的高锰酸钾溶液褪色。经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O。
CH2=CH2↑+H2O,加热一段时间后溶液中有黑色现象出现。过一段时间后,经硫酸酸化的高锰酸钾溶液褪色。经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O。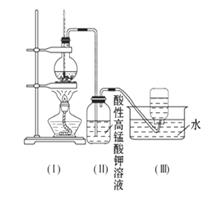
酸性高锰酸钾溶液褪色,甲同学认为能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为不能证明乙烯被酸性高锰酸钾溶液氧化了。
(1)你认为哪个同学的观点正确? _____ (填“甲”或“乙”),理由是(从下列选项中选)_____
| A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了氧化反应 |
| B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了加成反应 |
| C.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,不能证明通入的气体是纯净物 |
| D.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,只能证明通入的气体一定具有还原性 |
(2)丙同学取(Ⅱ)瓶中少量溶液于试管里,加入盐酸和氯化钡溶液,产生白色沉淀,他认为乙烯中一定混有二氧化硫,你认为他的结论是否可靠? _____ (填“可靠”或“不可靠”);理由是_____________________ 。
(3)丁同学想证明乙烯能否与溴发生反应,于是对上述实验进行了改进,改进的方法是:在装置(Ⅰ)和(Ⅱ)之间增加一个装有足量_____的洗气瓶,且将(Ⅱ)瓶中溶液换成_____ 。发生加成反应的化学方程式为