(共9分)乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。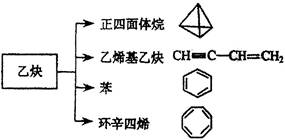
完成下列各题:
(1)正四面体烷的分子式为 ,其二氯取代产物有 种。
(2)关于乙烯基乙炔分子的说法正确的是 。
a. 能使酸性KMnO4溶液褪色
b. 1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应
c. 乙炔其乙炔分子内含有两种官能团
d. 等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的所有分子的结构简式:
。
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例)
(小于10个碳原子): , 。
Na2O2可用在潜水艇里作为氧气的一种来源,供人们呼吸所需。Na2O2所发生反应的化学方程为 。在这个反应中,电子转移的总数为 被氧化的是 价态 元素,氧化剂是 。
如下图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g) Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
(1)B中X 的转化率α(X)B为。
(2)A中W和B中Z的物质的量的比较:n(W)An(Z)B(填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为升(用a表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是。
(10 分)(1)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的P亚层上有3个电子。
①写出甲元素的电子排布式________________________;
②甲、乙元素的第一电离能关系为甲乙(填>、<、=);两元素可形成硬度大于金刚石的一种化合物,该化合物属于______晶体,其化学式为_____________,若使其熔化,需破坏的作用关系为___________________.
(2)人们一直致力于人工固氮的研究,以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物,其中一类是含Mo、Fe、S原子的类立方体结构,如下图所示:图中左右两边对称,各含一个近似为立方体的结构,每个立方体含有4个Fe原子、4个S原子,它们位于立方体的8个顶点,且原子间只有一个化学键。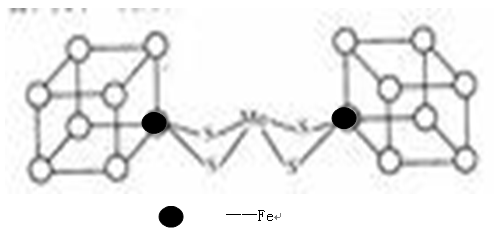
①请在图中左边立方体的○中填写出(在○涂黑)其余3个Fe原子
②上述一个立方体中4个Fe原子所在的顶点连接所构成的空间几何体为______
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO2-4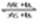 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是;电解液中H2SO4的浓度将________(填变大、变小、不变);当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成_____、B电极上生成_____________,此时铅蓄电池的正负极的极性将________________。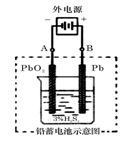
.下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4500ml的操作,请按要求填空:
(1)所需浓H2SO4的体积为mL
(2)如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好。量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将(偏高、偏低、无影响)。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的小烧杯里,并不断搅拌,目的是。