为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则甲醇的标准燃烧热ΔH= 。
(2)今有如下两个热化学方程式:则a b(填“>”、“=”或“<”)
H2(g)+ 1/2O2(g)=H2O(g) ΔH1=a kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(l) ΔH2=b kJ·mol-1
(3)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 |
H-H |
N-H |
N≡N |
| 键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2(g)+3H2(g)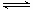 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________(注明“+”或“-”)。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________(注明“+”或“-”)。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ;
CH3OCH3(g) + CO2 (g)的ΔH= ;
已知:A为酸式盐,B为某二价主族金属元素的化合物,其中B的化学式中共有32个电子, 常温常压下C、D、F、G、I均呈气态 ,除G呈红棕色外其他气体均为无色。等物质的量A、B与少量的水充分混合能恰好完全反应。图中反应条件(除高温外)均已略去。
(2)写出A与B反应的化学方程式。
(3)写出下列反应的离子方程式:
①在A溶液中加入M
②向A溶液中加入过量NaOH溶液,并加热
(4)C还可在纯氧中安静燃烧,产物为H和一种单质,写出该反应的化学方程式:
A、B、C、X均为中学化学中常见的纯净物,它们之间有如图所示的转化关系(副产物已略去)。
试回答:
(1)若X是强氧化性单质,则A可能是。(填序号)
a、S b、Na c、Mg d、Al
(2)若X为金属单质,向C的溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为;C溶液在储存时应加入少量X,理由是(用离子方程式表示)。
(3)若A、B、C为含同种金属元素的无机化合物,X为强酸或强碱。A和C在H2O溶液中反应生成B的离子方程式为。
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条
件:①元素周期表中,Z与Y相邻,Z与W相邻;②X分别与Y、Z、W可组成化学式为YX3、X2Z和X2W三种共价化合物。请填空:
(1)X、Y、Z原子最外层电子数之和是;
(2)X2W的电子式是 ,YX3、X2Z和X2W形成的晶体类型都属于;
(3)X、Y和Z组成的一种化合物是强酸。写出该酸的稀溶液与铜反应的离子方程式;X、Y和Z组成的另一种化合物是离子化合物,该离子化合物在210℃分解生成一种只含Y、Z的气体和一种只含X、Z的液体(在常温、常压下)。已知40g该离子化合物完全分解可生成11.2L的气体(标准状况下),该气体的化学式为:;
(4)X、Y、Z和W组成一种化合物,其原子个数之比为5:1:3:1;该化合物具有还原性。
①写出该化合物与过量稀NaOH溶液反应的离子方程式:。
②请设计实验证明该化合物具有还原性:
。
(1)某学生在实验室做了5个实验
①在铝盐溶液中逐滴加入稀氨水直至过量,
②在明矾溶液中加入NaOH溶液直至过量,
③在强碱性溶液中逐滴加入铝盐溶液直至过量,
④在偏铝酸钠溶液中通入CO2直至过量,
⑤在强酸溶液中逐滴加入偏铝酸钠溶液直至过量。
并根据以上实验画出下列5种图象(纵坐标为沉淀的物质的量,横坐标为溶液中加入物质的量)实验与图象对应关系正确的是:___________。
| A.①和(a) | B.②和(b) | C.③和(e) | D.④和(c) |

(2)已知:氧化性:KMnO4>HNO3;Bi位于周期表中VA,+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,
请回答下列问题:
(a)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为__________________________;
(b)实验④中的现象为:______________________________;
(c)实验②③反应的离子方程式分别是:
____________、______。
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
⑴图中的两处明显的错误是
_____________________________________。
_____________________________________。
⑵A仪器的名称是___________,
B仪器的名称是。
⑶实验时A中除加入少量自来水外,还需加入少量,
其作用是_____。