如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
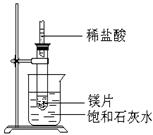
(1)实验中观察到的现象是
(2)产生该现象的原因
(3)写出有关反应的离子反应方程式
(4)有此推知,MgCl2溶等于液和H2的总能量 填 (“大于”“小于”或“”)镁片和盐酸的总能量
硝酸铵是含氮量较高的化肥,生产流程如下(产物水均已略去):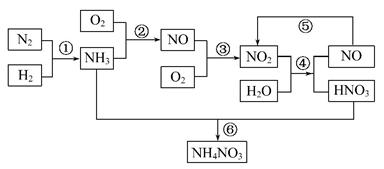
(1)反应④的化学方程式为3NO2+H2O====2HNO3+NO,该反应的氧化剂为 ,还原剂为 。
(2)补充并配平反应②的化学方程式:
NH3+ O2 NO+ 。
NO+ 。
(3)化学反应 (填序号)是非氧化还原反应,离子方程式为 。
(4)有人设计了一个反应来制备硝酸:NO2+NH3 HNO3+H2O(未配平),你认为该反应
HNO3+H2O(未配平),你认为该反应
(填“能”或“不能”)发生,理由是 。
A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):
A B
B C
C D。
D。
(1)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红,则A为 。写出A→B转化的化学方程式:
。
(2)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,则C是 。A跟水发生反应的离子方程式为 。
)氮元素的化合价较多,负价态氮与正价态氮之间发生氧化还原反应时会有氮气产生。下面是甲、乙两位学生提出的两种制备少量氮气的实验方案(箭头表示气体的流向)。
甲:空气→碱石灰→红磷(点燃)→水→铜粉(灼热)→集气瓶
乙:NH4NO2(加热)→浓硫酸→镁粉(灼热)→集气瓶(提示:NH4NO2 N2↑+2H2O)
N2↑+2H2O)
回答下列问题:
(1)甲、乙两位学生的实验方案是否能制氮气?
甲 、乙 (填“能”或“不能”)。
(2)具体说明不能制取氮气的原因并纠正(若两种方案都能制氮气,此小题不用回答) 。
(3)甲方案中碱石灰和乙方案中浓硫酸可否交换位置?说明理由:
。
今年我国多个城市遭雾霾天气,这表明污染严重,空气质量下降。因此研究NO2、SO2、CO等大气污染气体的处理具有重要现实意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。
(2)利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
(3)硝酸工业尾气中含NO和NO2气体,常用NaOH溶液来吸收,反应方程式为NO+NO2+2NaOH====2NaNO2+H2O,该反应中氧化剂和还原剂的物质的量之比是 。
(4)SO2是形成酸雨的主要物质,可以用氨水吸收消除污染,写出过量氨水与SO2反应的离子方程式 。
含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移方向和数目
。
(2)Ba2+有剧毒。某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒。试写出碳酸钡与胃酸(以盐酸表示)反应的离子方程式
。
患者被送往医院后,医生往往让其服用
(填题干所列7种物质中的1种)来解毒。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面
,
则发生了钝化;若铁棒表面 ,则未发生反应。