0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6 g。
(1)判断该有机物的化学式。
(2)若0.2 mol该有机物恰好与4.6 g金属钠完全反应,试确定该有机物的结构简式。
硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物。
(1)将SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀。溶液由棕黄色变为浅绿色用离子方程式表示为_____,后又由浅绿色变为棕黄色的离子方程式为_____。
(2)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCI为原料可以合成有重要用途的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下: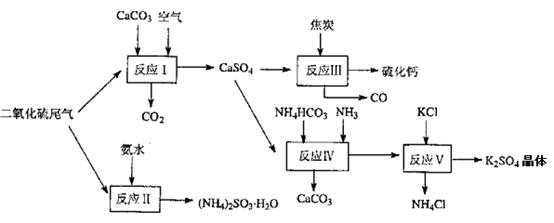
写出反应反应Ⅳ的化学方程式;
反应III中氧化剂与还原剂的物质的量之比为____;
反应V在25'C、40%乙二醇溶液中进行,该复分解反应能顺利进行的原因是。
(3)新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下能使SO2分解,减小工业废气对环境的影响,它由铁酸锌(ZnFe2O4)经高温还原制得,转化流程如下图所示:
若2molZnFe2Ox与SO2反应可生成 0.75molS,x=,写出铁酸锌高温下被还原生成氧缺位铁酸锌的化学方程式
(4)石灰石-石膏湿法烟气脱硫工艺技术的原理是烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4.2H2O),写出该反应的化学方程式。某电厂用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则可生产石膏t。
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
部分含钒物质在水中的溶解性如下:
回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热法,该反应的化学方程式为_______
(2)为了提高钒的浸出率,用酸浸使催化剂中的V2O5转变成可溶于水的VOSO4,与水浸液合并,再用KClO3氧化,使+4价的V氧化成易溶于水的(VO2)2SO4。反应①的离子方程式为_______;反应②的离子方程式为ClO3-+6VO2++3H2O=6VO2++6H++Cl-。
(3)该工艺中反应③的沉淀率是回收钒的关键之一,该步反应的离子方程式为_______。
(4) 实验室用的原料中V2O5占6%(原料中的所有钒已换算成V2O5)。取100g该废钒催化剂按工业生产的步骤进行实验,当加入100 mL 0.1 mol·L-1的KC1O3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是_______ (已知V2O5的相对分子质量为182)。
(5)全钒液储能电池是利用不同价态的离子对之间的氧化还原反应来实现化学能和电能相互转化的装置,其原理如右下图所示。已知电池的总反应式为VO2++V2++2H+ VO2++V3++H2O
VO2++V3++H2O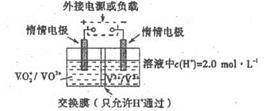
①放电时的正极反应式为______________。
②放电过程中氢离子的作用是______________,充电时若转移的电子为2mol,则左槽溶液中n(H+)的变化量为______________。
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为: ,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
①反应 0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强(填“增大”、“减小”或“不变”),平衡移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量__(填“增大”、“减小”或“不变”),O2的物质的量浓度(填“增大”、“减小”或“不变”)。
0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强(填“增大”、“减小”或“不变”),平衡移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量__(填“增大”、“减小”或“不变”),O2的物质的量浓度(填“增大”、“减小”或“不变”)。
②若温度为T1、 T2,反应的平衡常数分别为K1、K2则K1K2(填“>”、“<”或“=”),反应进行到D点状态时,V正V逆(填“>”、“<”或“=”)
③在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10 mol O2,在500℃开始反应,半分钟达到平衡,测得容器内含SO3 0.18 mol,则v(O2)=mol·L-1·min-1,若继续通入0.20 mol SO2和0.10 mol O2,平衡发生了移动,再次达到平衡后,mol<n(SO3)<mol.
(2)已知三种无色溶液:a.NaHCO3溶液,b.AlCl3溶液,c.NaAlO2溶液,它们两两反应均能生成Al(OH)3沉淀。请回答下列问题:
①两种溶液恰好完全反应,所得溶液中c(OH—)= 是水的离子积),则这两种溶液可为(填字母)。
是水的离子积),则这两种溶液可为(填字母)。
②能体现出NaHCO3在反应中,HCO—3的水解程度小于电离程度的离于方程式为。
工业制硫酸时,利用催化氧化反应将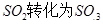 是一个关键的步骤。
是一个关键的步骤。
(1)某温度下,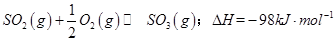 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
(2)一定条件下,向一带活塞的密闭容器中充入2mol mol
mol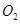 ,发生反应:
,发生反应: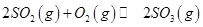 ,达平衡后改变下述条件,
,达平衡后改变下述条件, 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。
A.保持温度和容器体积不变,充入2mol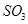 |
| B.保持温度和容器体积不变,充入2molN2 |
C.保持温度和容器内压强不变,充入1mol |
| D.移动活塞压缩气体 |
E.升高温度
(3)下列关于 反应的图像中,不正确的是_________。
反应的图像中,不正确的是_________。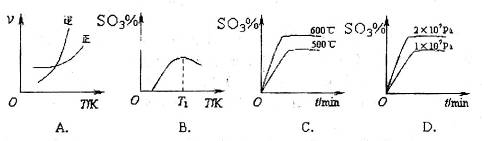
(4)同学们学习了电化学知识后大家提出,可以用电解的方法来生产硫酸,可避免产生酸雨,污染环境。于是大家设计了一个以铂为电极,两极分别通入SO2和空气,酸性电解液来实现电解生产硫酸。
①阳极的电极反应为______________________________。
②若电解液为2L0.025mol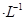 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。
③设计此实验的想法得到了老师的充分肯定,但与工业上生产硫酸相比还是有很多不足,请对此实验进行合理的评价____________________________(写出一点即可)。
在200mL的混合溶液中,硝酸和硫酸的物质的量的浓度均为0.2mol/L,向该混合液中加入3.84g的铜,加热使其充分反应。试计算:
(1)理论上生成的一氧化氮(标准状况下)的体积是多少升?
(2)若反应后溶液的体积不发生变化,溶液中Cu2+物质的量浓度是多少?