)如图是氯化钠的晶胞示意图,回答如下问题: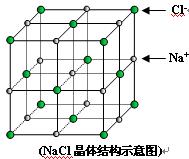
(1)在NaCl晶体中,与每个Cl-距离等同且距离最近的几个Na+所围成的空间几何构型为__________。
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
(2)NaCl晶体中不存在分子,但是当温度达到1686 K时,NaCl晶体形成气体,并以分子形式存在。现有29.25 g NaCl晶体,强热使其气化,测的气体体积为5.6 L(已折算成标准状况)则此时氯化钠气体的化学式为_____________。
(3)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将固体NaCl细粒干燥后,准确称取a g NaCl固体并转移到定容容器A中;
②用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积为V cm3。步骤①中A仪器最好使用_______________。
A.量筒 B.烧杯 C.容量瓶 D.试管
(4)已知NaCl晶体中,距离最近的Na+与Cl-间的平均距离为b cm,用上述测定方法测得的阿伏加德罗常数NA的表达式为______________________。(用含V、a、b的代数式表示)
(12分)(1)已知在一定温度下:C(s)+CO2(g) 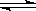 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g) 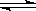 CO(g)+H2(g)平衡常数K1;
CO(g)+H2(g)平衡常数K1;
CO(g)+H2O(g)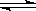 H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,
则K、K1、K2之间的关系是:。
(2)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阳极的电极反应式是 。
。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,装入锥形瓶中,用一定浓度的标准I2溶液进行滴定,所用指示剂为,滴定终点时的颜色变化为。
(4)用标准NaOH溶液滴定盐酸时,滴定前俯视读数,滴定后仰视读数,会造成测定结果。(填“偏大”、“偏小”或“无影响”)
(5)如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是。
把NaHCO3和FeCl3溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为。
(6)怎样除去锅炉中难溶的硫酸钙沉淀?
(7)某温度下,水的离子积常数Kw = 1.0×10-12mol2·L-2。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,当混合溶液的pH=7时,H2SO4溶液与NaOH溶液的体积比为。
某物质可能含有炭粉、碳酸钙、氧化铜、氧化铁中的一种或几种,现进行如下实验:
(1)取样品,加热至高温,产生一种能使澄清石灰水变浑浊的无色气体。
(2)往冷却后的固体残渣中加入足量的稀盐酸,固体残渣全部溶解,同时产生一种可燃性气体。根据以上实验推断:该固体一定含有_____________,一定不含有______________,可能含有_____________(以上各空填写化学式)
(1)新制氯水中含有的溶质有_____________,放久了的氯水会变为________________,写出变化过程中反应的化学方程式:①_____________________;②________________________。
(2)将新制的氯水分成三份:
①向其中第一份中滴入 溶液,离子方程式是;
溶液,离子方程式是;
②向第二份中滴入 溶液,离子方程式是;
溶液,离子方程式是;
③向第三份中滴入紫色石蕊试液,现象是先___________后_____________。
(3)工业上制取漂白粉的化学方程式是。漂白粉溶于水跟水中的 反应,生成具有漂白性的物质,其化学方程式是。
反应,生成具有漂白性的物质,其化学方程式是。
处于下列状态的物质中:①硫酸钡晶体②干冰③HCl气体 ④铜⑤蔗糖⑥熔融的硝酸钾⑧NaCl溶液 ⑨醋酸
(1)能导电的是(填字母,下同);
(2)属于电解质的是;强电解质;弱电解质;
(3)属于非电解质的是。
A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
请回答下列问题:
(1)写出B中官能团的名称;1mol B能与含______molBr2的溴水反应。
(2)既能使FeCl3溶液显紫色又能和NaHCO3反应放出气体的有(用A.B.C.D填空)。
(3)按下图C经一步反应可生成E,E是B的同分异构体,则反应①属于反应(填反应类型名称),写出反应②的化学方程式_______________________________________。
(4)同时符合下列两项要求的D的同分异构体有4种
①化合物是1,2——二取代苯;
②苯环上的两个取代基分别为羟基和含有-COO-结构的基团其中两种(G和H)结构简式如下图所示,请补充另外两种。 、 _____________________,
、 _____________________,
(5)写出H与足量NaOH溶液共热反应的化学方程式
________________________________.