近几年,大气污染越来越严重,雾霾天气对人们的生活、出行、身体健康产生许多不利的影响。汽车尾气是主要的大气污染源。降低汽车尾气危害的方法之一是在排气管上安装催化转化器,发生的反应为:
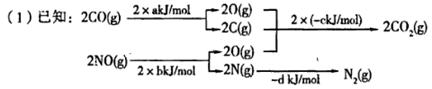
则 ,△H=__________kJ
,△H=__________kJ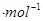 (用含a、b、c、d的式子表示)。
(用含a、b、c、d的式子表示)。
(2)某温度下,向容积为1L的容器中充人3 mol NO和1 mol CO, NO的转化率随时间的变化如下图所示。
回答下列问题:
①该温度下,化学平衡常数K=___________,平衡时CO的转化率为__________。
②A点的逆反应速率逆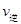 (CO)___________B点的逆反应速率
(CO)___________B点的逆反应速率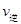 (NO)(填“>”、“<”或“=”)。
(NO)(填“>”、“<”或“=”)。
③下列图像正确且能表明在时间T1时刻反应一定处于平衡状态的是__________。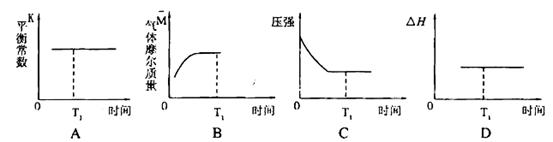
如果该反应达平衡后,降低温度,平衡常数增大,则△H___________0(填“>”、“< ”或“=”)
④达平衡后,将容器的容积扩大一倍,下列说法正确的是
| A.平衡向正反应方向移动 | B.CO的体积分数增大 |
| C.平衡常数减小 | D.一氧化碳的浓度增大 |
重铬酸钠(Na2Cr2O7)广泛用作氧化剂、鞣革剂等。以铬矿石(主要成分为
03,还含有FeO、A1203、Si02等杂质)为原料制取重铬酸钠的流程如下:
请回答下列问题:
(1)Cr203在高温焙烧时反应的化学方程式为。
(2)生产过程中,调节(含Na2Cr04、Na2Si03、NaAl02
的溶液)pH的目的是。
(3)某化工厂采用石墨作电极电解Na2Cr04溶液,实现了
Na2Cr04转化为Na2Cr207的生产,其原理如下图所示。
①写出阳极的电极方程式:;
②此生产方法和上述流程相比的优点主要有。
(4)Na2Cr207可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被
氧化所需要的02的质量)。现有某水样100.00 mL,酸化后加入cl mol/L。的
Na2Cr207溶液 mL,使水中的还原性物质完全被氧化(还原产物为
mL,使水中的还原性物质完全被氧化(还原产物为 );再用
);再用
 的FeS04溶液滴定剩余的
的FeS04溶液滴定剩余的 ,结果消耗FeS04溶液
,结果消耗FeS04溶液 mL。则该水
mL。则该水
样的COD为 。
。
某兴趣小组根据金属镁与C02的反应,推测金属钠也能与C02发生反应,因此
他们用下图所示的装置进行“钠与C02反应”的探究(尾气处理装置略去).又知实
验过程中的C02气体为足量;设能发生的反应都进行完全;一氧化碳气体可用氯化钯
(PdCl2)溶液来检验(通过溶液颜色的变化来判断)。
(1)为了使制取气体的装置能“随开随用,随关随停”,则在图中A处应选用的装置是(填“I”、“Ⅱ”或“Ⅲ”).若要用干燥、纯净的C02气体与金属钠反应,则装置B中应盛放的试剂是溶液。
(2)实验开始,检查装置的气密性完好并装入有关药品后,在点燃酒精喷灯前,还必须进行的实验操作是。
(3)反应完成后,装置D玻璃管中残留的固体物质可能是。(填字母) .Na202 b.Na2C03 c.NaHCO3 d.Na2C03和C
.Na202 b.Na2C03 c.NaHCO3 d.Na2C03和C
(4)若D玻璃管中残留的固体是纯净物,则钠与C02反应的化学方程式是。
(5)请设计合理的实验来检验某固体物质是Na2C03.答:。
某化学学习小组用如图所示装置研究不同条件下铁与硝酸反应的情况。其实验
步骤如下:
①在大试管中先加入一小块铁(过量),再加入一定量的浓硝酸;
②用仪器a再加入适量的水;
③反应结束后取少量上层溶液于另一试管中,滴加几滴KSCN溶液;
④再用仪器a向③的试管中滴加适量的稀盐酸。
请回答下列问题:
(1)仪器a的名称是 。
(2)步骤①无明显现象,原因是。
(3)步骤④的主要现象是,有关反应的离子方程式是。
(4)学习小组在进行实验后发现该实验装置存在着一种明显的缺陷,请给出一种简单
的消除此缺陷的措施:。
下列溶液中微粒的物质的量浓度关系正确的是
A.向硝酸钙溶液里滴加稀盐酸得到pH=4的溶液中: |
| B.将0.2 mol·L-1NaA溶液和0.1 mol·L-1盐酸等体积混合所得的碱性溶液中(A- 为酸根离子):c(Na+)>c(AlO2-)>c(C1-)>c(0H-) |
| C.0.1 mol/L-1NaAl02溶液中:c(Na+)>c(AlO2-)>c(OH-)>c(H+) |
| D.浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的混合溶液中: |
2c(OH-)=2c(H+)+c(CH3COOH)
硝酸 是一种重要的化工原料,工业上生产硝酸的主要过程如下:
是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。反应N2(g)+3H2(g) 2NH3(g)△H<0
2NH3(g)△H<0
①下列措施可以提高H2的转化率是(填选项序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的理是原来的 ,则N2的转化率a1=;
,则N2的转化率a1=;
若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸。
①NH3被氧气催化氧化生成NO的反应的化学方程式是。
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g)△H>0
2NO2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如右图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)。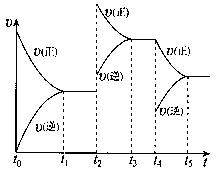
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~ t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用如下2种方法处理尾气。
①催化还原法:催化剂存在时用H 2将NO2还原为N2。
2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是。
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。
若每9.2gNO2和Na2FCO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是。