A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子。
请回答下列问题:
(1)当n=2时,AB2属于 分子(填“极性”或“非极性”),分子中
有 个σ键、 个π键。
(2)当n=3时,A与B形成的晶体属于 晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种原子的电负性由大到小的顺序是 (用元素符号表示)。
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O。该配合物中的中心离子钴离子在基态时的核外电子排布式为 ,作为配位体之一的NH3分子的空间构型为 。
(共10分)
有一类烷烃,其分子中只有一种氢原子(即:一卤代物只有一种的烷烃)。此系列烷烃的第二项可看成CH4及C2H6分子中所有氢原子被甲基(CH3-)代替后所得。CH4分子的空间形状可看成球形,而C2H6分子的空间形状可看成椭球形
(1)下表为一卤代物都只有一种的球形烷烃及椭球形烷烃系列,填写下表空白处。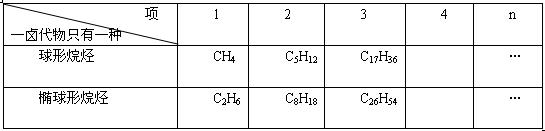
(2)只有一种氢原子的球形烷烃或椭球形烷烃系列中,相邻的两项中,后者每个分子中氢原子数是前者每个分子中氢原子数的倍
(3)根据上表中“一卤代物只有一种的烷烃”的分子式中有关规律,请你分别写出这两类烷烃的通式(通式中要求当n=1时,上述两系列的第一项分别为CH4及C2H6)。
①一卤代物只有一种的球形烷烃的通式是。
②一卤代物只有一种的椭球形烷烃的通式是。
2008年5月12日14时28分,四川省汶川县发生8.0级强烈地震,地震给受灾地区造成强烈的破坏作用。抗震救灾急需大量的药品(如抗生素等)、生活用品等
医学上普遍认为某些氨基酸(如:L-酪氨酸)是一种重要的生化试剂,是合成多肽类激素、抗生素的主要原料。
(1)酪氨酸的结构简式是: ,其与过量的NaOH溶液
,其与过量的NaOH溶液
反应的化学方程式是。
(2)丙氨酸分子中甲基上的一个氢原子若被苯基取代后即为苯丙氨酸。以下为苯丙氨酸的一种合成线路:
①上述反应a、b、c、d中,属于取代反应的有。
②在反应a中,若不使用过氧化物,则不能得到A,而是得到A的同分异构体。写出若不使用过氧化物时,反应a的化学方程式:。
③反应c的化学方程式是。
④同时满足下列条件的苯丙氨酸的同分异构体有种
x、分子中含有苯环; y、每个苯环上有两个取代基; z、含有硝基。
工业上用甲苯生产对-羟基苯甲酸乙酯: ,下列反应①~⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明)。
,下列反应①~⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明)。
回答下列问题:
(1)有机物A的结构简式为___________________。
(2)反应②的化学方程式是:__________________________________________。
(3)试剂x是,反应⑥的反应类型是反应。
(4)反应⑤的化学方程式是:_____________________________________。
(5)合成路线中设计③、⑤两步反应的目的是。
(1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图所示:
则苯氯乙酮不可能具有的化学性质是(填字母序号)。
a.加成反应 b.取代反应 c.消去反应
d.水解反应 e.银镜反应 f.还原反应
(2)有下列化合物: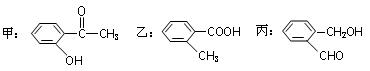
请按酸性由强至弱排列甲、乙、丙的顺序:。
(3)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料

①聚合物F的结构简式:。
②C与新制的Cu(OH)2共热转化为D的化学方程式是:
。
③在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是:
从下列选项中选择适当的字母填空。
| A.渗析 | B.凝聚 | C.盐析 | D.布郎运动 E.电泳 F.丁达尔现象 |
(1)Fe(OH)3胶体呈红褐色,插入两个惰性电极,通直流电一段时间,阴极附近的颜色逐渐变深,这种现象叫。
(2)一束光线通过Fe(OH)3胶体,可看到光亮的通道,这种现象叫。
(3)将淀粉和食盐的混合溶液放在半透膜制成的口袋中,并把它悬挂在盛有蒸馏水的烧杯里,从而使淀粉与NaC1分离,这种方法叫。
(4)Fe(OH)3胶体加入硅酸胶体后变浑浊,这是发生了
(5)向油脂皂化反应后所得的溶液中加入细粒食盐使肥皂析出,这种操作是。