镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
试回答下列问题:
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用 ,反应的离子方程式为 ;
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是 ;
(3)试剂②可以选用 ;
(6分 )某药品标签上贴有OTC,它表示 ,阿司匹林的化学学名是,青霉素G的钠盐俗名叫
)某药品标签上贴有OTC,它表示 ,阿司匹林的化学学名是,青霉素G的钠盐俗名叫
人的纯净胃液是一种无色液体,呈酸性,pH在0.9~1.5之间, 其中H+ 的浓度比血液中高几万倍,回答下列问题:
①胃液有帮助人体消化食物等多种功能,胃酸的主要成分是。
②若胃酸酸度增高就会患胃酸过多症,下列物质不宜用做治疗胃酸过多的药物的是()
| A.小苏打粉 | B.氢氧化铝粉 | C.氢氧化钠粉末 | D.纯碳酸钙粉 |
③胃舒平主要成分是氢氧化铝,不溶于水且作用持久,写出该药物中和胃酸的化学方程式: 。
。
淀粉和纤维素的分子组成都可以用通式____表示,蛋白质水解的最终产物分子中,含有的官能团是 _和( 填官能团名称)。
下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合化学和生物学科的知识,回答下列问题。
(1)要在食盐中加碘,是因为碘是人体内合成____________激素的主要原料,缺碘会引起疾病。
(2)食盐中加碘,这碘指的是(填化学式),其中碘元素的化合价为__________。
(1)维生素C的结构简式为 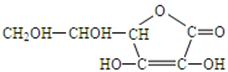
请回答:①维生素C的分子式是
②向维生素C的水溶液中滴加紫色石蕊试液,试液变红,说明维生素C的水溶液显性。
(2)铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
维生素C在这一反应中具有性;维生素C又称为。
(3)黄瓜中含有多种营养成分,尤其是维生素C和B的含量比西瓜高出1~5倍。已知高温时维生素会被破坏,维生素C在酸性环境时较稳定。根据上述内容,你认为应如何合理的食用黄瓜?