(方程式每空2分,其余每空1分,共20分。)氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题:
(Ⅰ)下列一组有水参与的反应:
①2Na + 2H2O =" 2NaOH" + H2↑②2Na2O2 + 2H2O =" 4NaOH" + O2↑
③Na2O+ H2O =2NaOH④3Fe+4H2O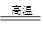 Fe3O4+4H2
Fe3O4+4H2
⑤2H2O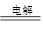 2H2↑+ O2↑⑥2F2 + 2H2O =" 4HF" + O2
2H2↑+ O2↑⑥2F2 + 2H2O =" 4HF" + O2
(1)其中不属于氧化还原反应的是(填编号)
(2)在这些氧化还原反应中,水只作氧化剂的反应是(填编号)
水只作还原剂的反应是(填编号)
水既作氧化剂,又作还原剂是(填编号)
水既不作氧化剂,又不作还原剂是(填编号)
(3)根据你的理解,氧化还原反应的实质是()
| A.分子中的原子重新组合 | B.氧元素的得失 |
| C.电子的得失或共用电子对的偏移 | D.化合价的改变 |
(4)请你运用所学知识分析3NO2+H2O = 2HNO3+NO是否属于氧化还原反应?(填“是”或“不是”),若是,这个反应的氧化剂和还原剂的质量比是。
(Ⅱ)写出下列反应的离子方程式:
①铜片与稀硝酸的反应:
②过量二氧化碳通入澄清石灰水:
③往氯化铝溶液中加入过量的NaOH溶液:
(Ⅲ)写出下列反应的化学方程式:
①二氧化硫发生催化氧化反应:
②制漂白液的反应:
③雕刻花玻璃的反应:
(10分)某化学兴趣小组进行如下图所示的电化学实验,实验前查资料获知:铁氰化钾
(K3[Fe(CN)6])遇Fe2+产生 蓝色沉淀。V形管以多孔Pt为电极;U形管A端滴入1~2滴K3[Fe(CN)6]溶液。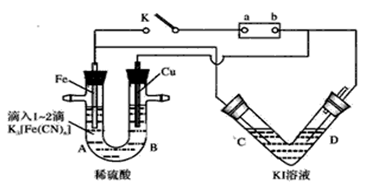
(1)开始时,接通K电键:U形管中无沉淀,可知电源正极为(填“a”或“b”).Fe电极上发生的电极反应为。
(2)断开K电键,V形管中为将能转化为能的装置;U形管A端现象为。
W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W,X,Y,Z。
(2)XW4分子中,中心原子属于杂化,分子的空间构型为;
根据电子云重叠方式的不同,分子里共价键的主要类型为。
(3)写出Y原子价层电子的排布图
(4)X的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为。
(1)等物质的量的A和B,混合于2L的密闭容器中,发生反应3A(g)+B(g)=xC(g)+2D(g),经过5min时,测得D的浓度为1mol/L,c(A):c(B)=3:4,C的反应速率是0.2mol•L-1•min-1,A在5min末的浓度是______,x的值是______.
(2)1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图(各物质为气体)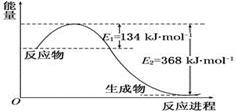
写出NO2和CO反应的热化学方程式____________________
(3)已知可逆反应:M(g)+N(g)  P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1, c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为____
②平衡后,升高温度,平衡常数。(增大、减小)
(4)t ℃时,水的离子积常数为1×10-13,则该温度25℃(填大于,小于)。若将此温度下PH=11的苛性钠溶液a L与PH=1的稀硫酸b L混合(忽略混合后体积变化),若所得混合液为中性,则a :b=。
(5)已知298K时, Ksp(CaCO3)=2.80×10-9, Ksp(CaSO4)=5.6×10-5,求此温度下该反应 的平衡常数K的数值为____
的平衡常数K的数值为____
(10分)有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色 黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍 |
试通过计算填空: |
| (1)A的相对分子质量为______ |
|
| (2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g |
(2)A的分子式为______ |
| (3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况) |
(3)用结构简式表示A中含有的官能团是______ |
(4)A的核磁共振氢谱如下图: |
(4)A中含有______种氢原子 |
| (5)综上所述,A的结构简式为________ |