高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)  Fe(s)+CO2(g) △H>0
Fe(s)+CO2(g) △H>0
试回答下列问题:
⑴铁在元素周期表中位于 ▲ 周期 ▲ 族。
⑵写出该反应的平衡常数表达式: ▲ ,升高温度,该反应的平衡常数K值将
▲ (填“增大”、“减小”或“不变”,下同),平衡体系中固体的质量将 ▲ 。
⑶为减少高炉冶铁时,含有CO的尾气排放,下列研究方向不可取的是 ▲ 。
| A.其它条件不变,增加高炉的高度 | B.调节还原时的炉温 |
| C.增加原料中焦炭与赤铁矿的比例 | D.将生成的铁水 及时移出 及时移出 |
⑷1100℃时, FeO(s)+CO(g)  Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2g的FeO,同时通入4.48L的CO气体(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为 ▲ 。(精确到0.1%)
Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2g的FeO,同时通入4.48L的CO气体(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为 ▲ 。(精确到0.1%)
下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)D的化学式为 ;F的结构式为 。
(2)A与B反应的化学方程式为 。
(3)E与G的稀溶液反应的离子方程式为 。
(4)B和C反应的化学方程式为 。
(5)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式 。
以下是依据一定的分类标准,对某些物质与水反应情况进行分类的图示。
请根据你所学的知识,按要求填空:
(1)上述第一级分类标准(分成A、B组的依据)是 。
(2)F组中物质除了Cl2外还有 (填化学式)。
(3)A组中的CaO经常用作食品包装袋中的干燥剂,CaO所属的物质类型为 (用序号填空)。
①金属氧化物;②碱性氧化物;③碱;④碱性干燥剂
CaO可作干燥剂的理由是(用化学方程式表示)。
(4)D组中NH3的水溶液呈弱碱性,用电离方程式表示其呈弱碱性的原因: 。
(5)由Al3+制备Al(OH)3,最好不选择D组中的NaOH溶液,说明理由: 。
亚硫酸钠中的+4价硫,既有氧化性,又有还原性。现有试剂:溴水、Na2S溶液、 Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有_____,看到的现象是___________________________________。
反应的离子方程式为:_______________________。
(2)要证明Na2SO3具有氧化性,应选用的试剂有_____,看到的现象是___________________________________。
反应的离子方程式为:_______________________。
有一混合气体,可能由H2、O2、NH3、N2、CO2、HCl和He中的两种或多种组成。常温下,取此气体200 mL进行实验,实验的过程和结果如下:
①观察此混合气体为无色。
②将此气体通过浓硫酸,气体体积减少了40 mL。
③将②中剩余的气体,通过Na2O2固体,气体体积变为120 mL。
④将③中剩余的气体引燃充分反应后,冷却至常温,气体体积又减少了105 mL。(上述气体的体积都是相同条件下测定的)。
⑤剩余气体通过加热的铜网,剩余10 mL气体。
根据上述实验,试推断:
(1)混合气体中肯定存在的气体是_________,它们的体积分别为_________。
(2)混合气体中肯定不存在的气体是__________________。
(3)混合气体中可能含有的气体是_________,其体积共为_________。
为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某学生设计如下实验方案: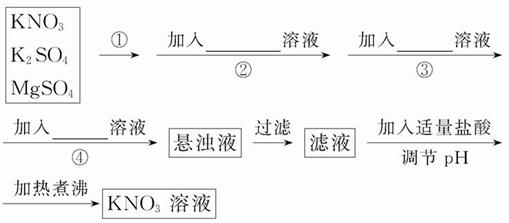
(1)操作①为___________________________。
(2)操作②~④加入的试剂依次可以为:___________________________________________________。
(3)如何判断SO42-已除尽?____________________________。
(4)实验过程中产生的多次沉淀_______ (填“需要”或“不需要”)多次过滤,其理由是_______________________________________________________。
(5)该同学的实验设计方案是否严密?请说明理由:___________________________________。