有50mL氢气和氯气的混合气体,经光照发生爆炸反应后恢复到原来的温度和压强,发现体积仍是50mL.试回答:
(1)若H2反应完全而Cl2有剩余,用实验进行验证的方法是 ;
(2)若H2与Cl2恰好完全反应,用实验进行验证的方法是 .
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1)在这些元素中,化学性质最不活泼的是:(填具体元素符号或化学式,下同)。
(2)各元素最高价氧化物的水化物中,酸性最强的是_______,碱性最强的是_______。
(3)写出④与⑤的最高价氧化物对应水化物互相反应的离子方程式__________ _。
(4)用电子式表示元素④与⑥形成的化合物:
(5)表示③与①最高价态形成的化合物结构式,
(6)写出元素②的最高价氧化物的水化物和它的气态氢化物反应的化学方程式
(7)③、⑥二种元素形成的氢化物沸点较高的是(用化学式表示),其原因是。
将下列物质中,找出合适的序号填在对应的空格内
①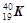 和
和 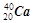 ; ②白磷与红磷 ③16O与18O ; ④O2与O3;
; ②白磷与红磷 ③16O与18O ; ④O2与O3;
⑤甲醇(CH3OH)和乙二醇(HO—CH2—CH2—OH); ⑥甲烷与丁烷;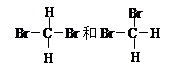 ⑦CH3-CH2-O-CH2-CH3与CH3CH2CH2CH2OH; ⑧胆矾与蓝矾
⑦CH3-CH2-O-CH2-CH3与CH3CH2CH2CH2OH; ⑧胆矾与蓝矾
⑨ 氯气和氯水⑩
注意:以上十组物质,不一定是每组物质都能找到对应填空
(1)互为同素异形体的是(填编号,下同)。
(2)互为同位素的是
(3)互为同分异构体的是(4)互为同系物的是
下列实验操作可以达到实验目的的是。
| A.只用溴的四氯化碳溶液就能鉴别乙烷与乙烯 |
| B.将蔗糖溶于水,加热后再加入少量新制的Cu(OH)2就可检验蔗糖的水解产物 |
| C.用玻棒取少许油脂的皂化反应液,滴于装有热水的试管中,振荡,若无油滴浮在液面上,说明油脂皂化完全。 |
| D.溴在有机溶剂中的溶解度比在水中的溶解度大,因此可用乙醇萃取溴水中的溴 |
E.用NaOH就可除去乙酸乙酯中的少量乙酸
在两支试管中加入等体积同浓度的硫酸铜溶液, 再分别加入少量等质量的锌粒和锌粉,振荡,观察现象。试回答:
(1)试管中溶液颜色有何变化?___________________________;
(2)两支试管中的现象有何不同?_____________。
(3)用简要文字和有关离子方程式解释上述现象。
____________________________________ 。
有一硝酸钾溶液,其中混入少量溴化钾和磷酸二氢钙。若拟用AgNO3、K2CO3、KOH和稀HNO3作试剂,除去那些混合物。若规定不得重复使用同种试剂,且所加试剂必须过量,最后溶液中只允许有K+、 和H+。则加入试剂的先后次序是,
和H+。则加入试剂的先后次序是,
,,。