将下列物质中,找出合适的序号填在对应的空格内
①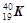 和
和 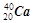 ; ②白磷与红磷 ③16O与18O ; ④O2与O3 ;
; ②白磷与红磷 ③16O与18O ; ④O2与O3 ;
⑤甲醇(CH3OH)和乙二醇(HO—CH2—CH2—OH); ⑥甲烷与丁烷;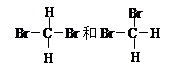 ⑦CH3-CH2-O-CH2-CH3与CH3CH2CH2CH2OH; ⑧胆矾与蓝矾
⑦CH3-CH2-O-CH2-CH3与CH3CH2CH2CH2OH; ⑧胆矾与蓝矾
⑨ 氯气和氯水 ⑩
注意:以上十组物质,不一定是每组物质都能找到对应填空
(1)互为同素异形体的是 (填编号,下同)。
(2)互为同位素的是
(3)互为同分异构体的是 (4)互为同系物的是
依据氧化还原反应2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如下图所示。请回答下列问题: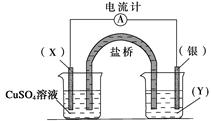
(1)电极X的材料是,电解质溶液Y是;
(2)银电极为电池的极,发生的电极反应为; X电极上发生的电极反应为。
(3)外电路中的电子是从电极流向电极。
物质在水溶液中存在的电离平衡、水解平衡和沉淀溶解平衡,都可看作化学平衡。请根据所学知识回答:
(1)在0.1mo1·L-1的NaHSO3溶液中存在的各种平衡体系为(用离子方程式表示):、、。
已知该溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO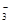 )>c(SO
)>c(SO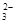 )>c(H2SO3)。则该溶液中c(H+)c(OH-) (填“大于”、“小于”或“等于”),简述理由:.
)>c(H2SO3)。则该溶液中c(H+)c(OH-) (填“大于”、“小于”或“等于”),简述理由:.
(2)常温下,某水溶液中存在的离子有:Na+、A—、H+、OH—,若该溶液由0.1mo1.L-1的HA溶液和0.1mol.L-1的NaOH溶液等体积混合而得,则溶液的pH (填“大于”、“小于”或“等于”)7,理由是。
已知某溶液中只存在OH-.H+.NH4+.Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种,请回答后面问题:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是(填序号)
(2)若溶液中只有一种溶质,则该溶质为,该溶液中离子浓度的大小关系为(填序号)
(3)若关系③正确,则溶液中溶质为。
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显(填“酸性”、“碱性”、“中性”)。
(5)25℃,pH="a" 的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则VaVb(填>、<、=、无法确定)
元素A的单质能与H2化合生成HxA,在标准状况下8.5gHxA气体的体积是5.6L。含5.1g的HxA的溶液与200ml0.75mol/l的CuCl2溶液正好发生复分解反应,并生成黑色沉淀和一种强酸,则:
(1)A 元素的相对原子质量,若A 的质子数等于中子数,则A是元素(填名称)。
(2)A的最高价氧化物是(填化学式)。这一氧化物在室温下呈态,将其熔化需要克服。
(3)HxA与CuCl2溶液反应的离子方程式。
(4)A的单质在常温下是固体,在常温常压下0.25mol该单质完全燃烧放出QkJ的热量。写出该反应的热化学方程式:。
五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。
回答下列问题:
(1)五种元素中,原子半径最大的是,非金属性最强的是(填元素符号)。
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是(用化学式表示)。
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为,其中存在的化学键类型为。
(4)单质D在充足的单质E中燃烧,反应的化学方程式为;
(5)单质E与水反应的离子方程式。