已知某溶液中只存在OH-.H+.NH4+.Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种,请回答后面问题:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是 (填序号)
(2)若溶液中只有一种溶质,则该溶质为 ,该溶液中离子浓度的大小关系为 (填序号)
(3)若关系③正确,则溶液中溶质为 。
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显 (填“酸性”、“碱性”、“中性”)。
(5)25℃,pH="a" 的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va Vb(填>、<、=、无法确定)
某双原子分子构成的气体,其摩尔质量为Mg·mol-1,该气体质量为mg,阿伏加德罗常数为NA,则:
(1)该气体的物质的量为 mol。
(2)该气体在标准状况下的体积为 L。
(3)该气体在标准状况下的密度为 g·L-1。
(4)该气体所含原子总数为 个。
(5)该气体的一个分子的质量为 g。
)在标准状况下,①6.72 L CH4气体;②3.01×1023个HCl气体分子;
③13.6 g H2S气体;④0.2 mol NH3,按下列要求对这四种气体的关系从大到小进行排列(用上述数字序号表示):
(1)标准状况下四种气体的体积 。
(2)四种气体的质量 。
(1)相同物质的量的CO2和O2,原子数目之比为 ,氧原子数目之比为 ;质量相同的CO2和O2,其物质的量之比为 。
(2)20.6 g NaR含有Na+0.2 mol,则NaR的摩尔质量为 g·mol-1,则含R 8.0 g的NaR的物质的量为 mol。
(1)3 mol KClO3完全分解,生成氧气的物质的量为 mol,其质量为 g。
(2) mol Zn和足量的HCl反应,生成氢气1.5 mol。
(3)与5.1 g某二元酸H2R完全反应,刚好消耗NaOH的质量为12 g,则H2R的摩尔质量为 。
(1)0.3 mol NH3分子中所含氢原子数与 个H2O分子中所含氢原子数相等。
(2)含0.4 mol Al3+的Al2(SO4)3中所含的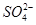 物质的量是 。
物质的量是 。
(3)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为 。
(4)2.3 g Na是 mol,含 mol e-。
(5)如果ag某气体中含有的分子数为b,则cg该气体的物质的量是(设NA为阿伏加德罗常数) mol。