(12分)从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。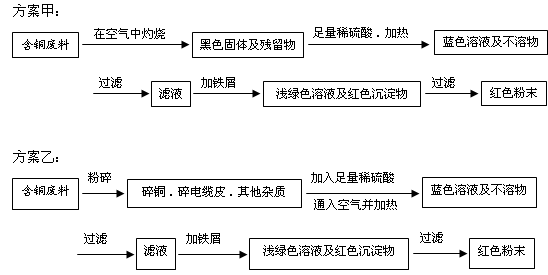
(1)两个方案中,符合当前生产中绿色化学理念的是方案 。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为 。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a g的晶体进行脱水实验,获得无水固体为(a-1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00 mol·L-1的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。通过计算测知该晶体的化学式是 。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5% 。工业上用硫酸铜等原料常通过下列反应制备CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3 =" 2" CuCl ↓+ 3 Na2SO4 + CO2↑
测定CuCl质量分数时先准确称取所制备的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液。有关反应的离子方程式为:Fe 3++CuCl=Fe 2++Cu2++Cl- ,Ce4+ + Fe 2+ = Fe 3+ + Ce3+
计算上述样品中CuCl的质量分数。(写出计算过程)
(16分,每空2分)(1)FeCl3的水溶液呈(填 “酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示):
“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”、“抑制”)其水解。
;实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”、“抑制”)其水解。
(2)醋酸电离方程式:,
氯化铝在水中电离方程式:_____________________________________ 。
把氯化铝溶液蒸干,灼烧,最后得到的主要固体产物是。
(3)热的纯碱溶液清洗油污效果比冷的好,这是因为。
(6分,每空2分) 按要求书写热化学方程式:
按要求书写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
。
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式
g白色沉淀,写出表示丁烷燃烧热的热化学方程式
。
(3)已知下列热化学方程式:
①CH3COOH(l)+2 O2(g)=2CO2(g)+2H2O(l) ΔH1=-87
O2(g)=2CO2(g)+2H2O(l) ΔH1=-87 0.3 kJ/mol
0.3 kJ/mol
②C(s)+O2(g) =CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+1/2O2(g) =H2O(l) ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式
。
已知:
从A出发可发生下图所示的一系列反应,其中G为高分子化合物,化合物B的分子式为C8H8O,当以铁作催化剂进行氯化时,一元取代物只有两种。
请填空:
(1)结构简式:A__________,M___________。 (2)反应类型:III__________,Ⅳ_________。
(3)写出下列反应的化学方程式:
C+D→H_________________________________。 F→G_________________ __。
__。
(4)与C互为同分异构体且均属于酯类的芳香族的化合物共有__________种
主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分别属于不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M常作为耐火材料。请回答下列问题:
(1)W原子L层电子排 布式为, W3空间构形是
布式为, W3空间构形是 。
。
(2)X单质与水反应的主要化学方程式。
(3)化合物M的化学式,将一定是的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂酸醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有,O-C-O的键角约。
(4) X、Y、Z可形成立方晶体的化合物,其晶胞中X占有棱的中心,Y位于顶角,Z位于体心位置,则该晶体的组成为X:Y:Z=。
(5)含有元素Z的盐的焰色反应为色,许多金属盐都可以发生焰色反应,其原因是。
A、B、C为中学常见单质,其中一种为 金属;通常情况下A为
金属;通常情况下A为 固体、B为液体、C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
固体、B为液体、C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
(1)写出下列物质的化学式: D___________; X____________;
(2)在反应①~⑦中,不属于氧化还原反应的是______(填编号)。
(3)反应⑥的离子方程式为:_____________________________________________________
(4)往G溶液中加入NaOH溶液观察到的现象是
(5)反应⑦的化学方程式为______________________________________________________;
该反应中每消耗0.3 mol的A,可转移电子_______________mol。
(6)写出D的溶液与小苏打溶液反应的离子方程式为________________________________。