有一硝酸钾溶液,其中混入少量溴化钾和磷酸二氢钙。若拟用AgNO3、K2CO3、KOH和稀HNO3作试剂,除去那些混合物。若规定不得重复使用同种试剂,且所加试剂必须过量,最后溶液中只允许有K+、 和H+。则加入试剂的先后次序是 ,
和H+。则加入试剂的先后次序是 ,
, , 。
质子核磁共振谱(PMR)是研究有机物结构的重要方法之一。在研究的化合物分子中:所处环境完全相同的氢原子在PMR谱中出现同一种信号峰:如(CH3)2CHCH2CH3在PMR谱中有四种信号峰。又如CH3-CHBr=CHX存在着如下的两种不同空间结构: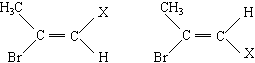
因此CH3-CHBr=CHX的PMR谱上会出现氢原子的四种不同信号峰。
请填写下列空白:
(1)化学式为C3H6O2的物质在PMR谱上观察到下列两种情况下氢原子给出的信号峰:第一种情况出现两个信号峰,第二种情况出现三个信号峰,由此可推断对应于这两种情况该有机物质结构式可能为:;;
(2)测定CH3CH=CHCl时:能得到氢原子给出的信号峰6种:由此可推断该有机物一定存在种不同的结构:其结构式为:。
写出下列物质的结构简式(每小题3分,共6分):
(1)2,2-二甲基-3-乙基己烷(2)2-甲基-2-丁烯
_______________________________、_____________________________
有A、B两种常温下有刺激性气味的气体,将A(g)通入品红溶液中,品红溶液变为无色;将B(g)通入品红溶液中,品红溶液也变为无色;将A(g)和B(g)按1:1的体积比混合充分,通入品红溶液中,品红溶液不褪色,通入紫色石蕊试液中,溶液只变红不褪色。试回答下列问题:
(1)写出A、B的化学式:____、____
(2)写出A和NaOH溶液反应的化学方程式:________
(3)写出B与NaOH溶液反应的离子方程式:________
(4)加热通入A后变为无色的品红溶液,现象是____;加热通入B后变为无色的品红溶液,现象是_____。
下表是元素周期表中的一部分。
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
E |
F |
H |
J |
||||
| 3 |
B |
C |
D |
G |
I |
根据A—J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是,氧化性最强的单质是。
(2)最高价氧化物对应的水化物中,碱性最强的是,酸性最强的是,呈两性的是。
(3)A分别与E、F、G、H、I形成的化合物中,最稳定的是。
(4)在B、C、D、G、I中,原子半径最大的是。
(5) 元素C与I形成的化合物的电子式的形成过程是:。
氮元素的单质和常见的化合物在工、农业生产中用途广泛。
(1)工业上利用分离空气的方法得到氮气。空气各主要成分的沸点如下:
| N2 |
O2 |
Ar |
CO2 |
| —196°C |
—183°C |
—186°C |
—78°C |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是 。
(2)雷雨时空气中的N2转化为NO,生成物NO是 色的气体, (填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应。NO2与水反应的化学方程式为 。
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气。
①制取氨气的化学方程为 ;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为 g。
(4)已知:4NH3+6NO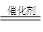 5N2+6 H2O 。化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。
5N2+6 H2O 。化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。
|
