已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示: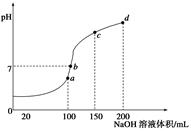
| |
I1 |
I2 |
I3 |
I4 |
| 电离能(kJ/mol) |
578 |
1817 |
2745 |
11578 |
(1)元素M的名称是_______________;
(2)硫原子核外有______种不同运动状态的电子,有______种不同形状的电子云;
(3)请用一个事实证明氧气的氧化性比硫的氧化性强:______________________________。
(4)相同条件下,0.1 mol/L NH4Al(SO4)2中c(NH4+)________(填“等于”、“大于”或“小于”)0.1 mol/LNH4HSO4中c(NH4+)。
(5)室温时,向100 mL 0.1 mol/LNH4HSO4溶液中滴加0.1 mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
①试分析图中a、b、c、d四个点,水的电离程度最大的是____________;
②在b点,溶液中各离子浓度由大到小的排列顺序是________;
③在c d段发生反应的离子方程式_________________。
400K,1.01×105 Pa时,2L烃A的蒸气能在m L氧气中完全燃烧,反应后体积增至(m + 4)L(体积在同前的条件下测定)。
(1)烃A在组成上应满足的条件是____________________。
(2)当m = 15时,该烃可能的分子式为__________________。
(3)若A在常温常压下为气态,m的取值范围是__________________。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) 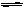 CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表:
CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表:
| t/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(填“吸热”“放热”)。
为体现绿色世博、低碳世博、科技世博,上海世博会已经开始使用中国自己生产的燃料电池汽车,该车以氢气和空气中的氧气为燃料,KOH为电解质溶液,真正实现了“零排放”。该电池的负极反应式为,从能量角度分析氢气用作燃料电池与直接燃烧相比主要优点是。
t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A (g)+B (g)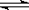 x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)v(B) =mol/(L·min),v(C) =mol/(L·min),x=。
(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)=;
(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是____________(填写字母序号)
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变
按下图装置进行实验,并回答下列问题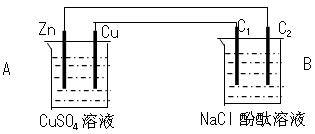
(1)判断装置的名称:A池为___________ , B池为______________
(2)锌极为__________极,电极反应式为_________________________
(3)石墨棒C1为______极,电极反应式为_______________________
石墨棒C2附近发生的实验现象为____________________________
(4)当C2极析出224mL气体(标准状态)时,锌的质量减少_________g。