(18分)在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经此反应的逆反应,生成颗粒很细的铁粉。某校化学小组利用下图所列装置进行铁与水反应的实验,并利用产物进一步与四氧化三铁反应制取铁粉。(装置中的铁架台、铁夹等必要的夹持仪器在图中均已略去)

(1) 烧瓶A中常加入碎瓷片,其作用是 ,
小试管C的作用是 。
(2) 为了安全,在E管中的反应发生前,在F出口处必须 ,
E管中的反应开始后, 在F出口处应 。
(3) 反应3Fe +4H2O(g)  Fe3O4 +4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释
Fe3O4 +4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释
。
(4) 停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中
含有Fe3+的实验操作及现象
。
海洋植物如海带、马尾藻等含有丰富的碘元素,实验室从海带中提取碘的流程如下:
(1)提取碘的过程中有关实验的操作名称①②③④
(2)写出过程②中有关反应的离子方程式;
该反应中氧化剂是,氧化产物是。
(3)提取碘的过程中,可选择得有机试剂是;
| A.酒精 | B.水 | C.四氯化碳 | D.甘油 |
在碘水中加入上述有机试剂,振荡静置,可观察到的现象是
海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:
(1)指出提取碘的过程中有关的实验操作名称:
①;③______________________。
写出实验②中有关反应的离子方程式 _______________________。
(2)提取碘的过程中,可供选择的有关试剂是___________。
| A.甲苯,酒精 | B.四氯化碳,苯 |
| C.汽油,乙酸 | D.汽油,甘油 |
(3)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出上图实验装置中的错误之处:①②③。
(4)进行上述蒸馏操作时,使用水浴的原因是___________;最后,晶态碘在___________里聚集。
Ⅰ.下列有关操作正确的是_。
①FeBr3作催化剂,苯和溴水发生反应可生成无色、比水重的液体溴苯
②将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,实现乙醇被氧化为乙醛的实验
③用Cu和Ag作为两极,H2SO4溶液作为电解质溶液,可以构成原电池
④为了防止自来水管生锈,一般在表面镀上一层Zn
⑤使用AgNO3溶液验证三氯甲烷中是否含有氯元素,现象是产生白色沉淀
A.②④B.①②C.③⑤D.④⑥
Ⅱ. 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用
是:。
(2)已知下表数据:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/(g/cm3) |
| 乙醇 |
-144 |
78 |
0.789 |
| 乙酸 |
16.6 |
117.9 |
1.05 |
| 乙酸乙酯 |
-83.6 |
77.5 |
0.90 |
| 浓硫酸 |
—— |
338 |
1.84 |
①按装置图安装好仪器后,需要试剂为3 ml 乙醇,2 ml乙酸,适量浓硫酸,请选择合适的加入顺序。
A. 先加浓硫酸,再加乙醇,最后加乙酸
B. 先加乙醇,再加浓硫酸,最后加乙酸
C. 先加乙酸,再加浓硫酸,最后加乙醇
D. 先加浓硫酸,再加乙酸,最后加乙醇
②根据上表数据分析,为什么乙醇需要过量一些,其原因是。
(3)按正确操作重新实验,该学生很快在小试管中收集到了乙酸乙酯、乙酸、乙醇的混合物。现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。在图中圆括号表示加入适当的试剂,编号表示适当的分离方法。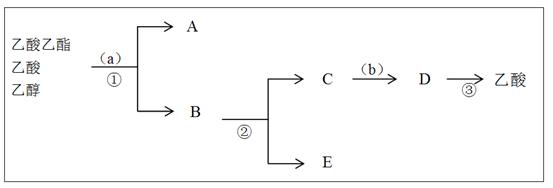
①写出加入的试剂名称: 试剂(a)是;试剂(b)是。
②写出有关的操作分离方法:①是,②是,③是。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液。以0.14mol/L的NaOH溶液滴定上述稀H2SO4 25mL,滴定终止时消耗NaOH溶液15mL,其操作分解为如下几步:
| A.移取稀H2SO4 25.00 mL,注入洁净的锥形瓶中,并加入2-3滴指示剂。 |
| B.用蒸馏水洗涤滴定管,后用标准溶液润洗2-3次。 |
| C.取标准NaOH溶液注入碱式滴定管至 “0”或“0”刻度线以上。 |
| D.调节液面至 “0”或“0”以下某一刻度,记下读数。 |
E.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液。
F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点,记下滴定管液面读数。
就此实验完成填空:
(1)①滴定操作的正确顺序是(用序号填写)。
②该滴定操作中应选用的指示剂是。
③在F操作中如何确定终点?。
(2)该滴定过程中,造成测定结果偏高的原因可能有哪些。
①配制标准溶液的NaOH中混有Na2CO3杂质
②滴定终点读数时,俯视滴定管的刻度,其他操作正确
③ 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
④滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
⑤滴定前碱式滴定管尖嘴部分未充满溶液
⑥滴定中不慎将锥形瓶内液体摇出少量于瓶外
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度 mol/L(保留2位小数)
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
P H=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________ (选填“是”或“否”)。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________。