下列实验操作或对实验事实的描述不正确的是 (填序号)
① 已烷中混有已烯,加入足量的溴水,充分振荡,静置分层后分离
② 配置硫酸铜溶液时应向溶液中加入少量的铜粉
③ 实验室可以用双氧水和二氧化锰制取少量的氧气
④ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑤ 向某溶液中先通入Cl2再滴加KSCN溶液时溶液变红,证明该溶液一定含有Fe2+
⑥ 将Fe(NO3)2溶液加热蒸发至干并灼烧,最后得到红棕色粉末
⑦ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
⑧在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成
Ⅰ、某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
(1)甲同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其设计的依据是 ;但该装置存在缺陷,请指出 。
(2)乙同学设计了如图2装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。乙同学可能观察到的现象
A. ;B. ;C. 。
从环保角度考虑,该装置有明显不足,请指出提出改进建议 。
Ⅱ、另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。
步骤一:电解精制:电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
| 序号 |
反应 |
平衡常数 |
| 1 |
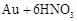  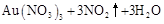 |
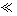 1 1 |
| 2 |
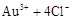  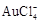 |
 1 1 |
请根据以上信息简要解释溶解阳极泥不用王水的原因 。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程。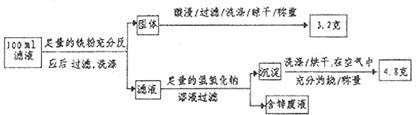
则 滤液中
滤液中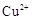 的浓度为
的浓度为 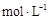 ,
,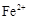 的浓度为
的浓度为 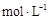 。
。
用下图装置进行 转化为
转化为 的转化率测定实验:
的转化率测定实验:


 。已知:
。已知:
熔点( ) ) |
沸点( ) ) |
|
 |
-72.4 |
-10 |
 |
16.8 |
44.3 |

(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接合适的装置(可重复使用),请从下列A~E中选择适宜的装置,将其序号填入空格内。
(2)将装置连接好,实验前,必须进行的操作是(不必写具体过程) 。
(3)实验时,浓硫酸有顺利滴入烧瓶中,甲装置所起作用的原理是 。
(4)开始实验时,先从乙处均匀通入 ,为使
,为使 有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 。
有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 。
(5)实验中“当 表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是 ;若用大火加热有
表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是 ;若用大火加热有 处的反应管时,
处的反应管时, 的转化率会 (填“升高”、“降低”或“不变”)。
的转化率会 (填“升高”、“降低”或“不变”)。
(6)实验时若用25.2g的 ,加入的浓硫酸是足量的,反应结束时继续通入
,加入的浓硫酸是足量的,反应结束时继续通入 一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中
一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中 的转化率为 %(保留小数点后一位)。
的转化率为 %(保留小数点后一位)。
(10分)垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。实验方案如下: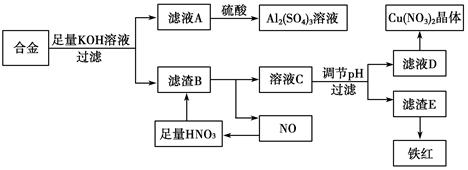
(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:__________________。
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中可用作调整溶液C的pH的试剂是________(填序号)。
| A.铜粉 | B.氨水 | C.氢氧化铜 | D.碳酸铜 |
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,溶液中c(Fe3+)=____________,此时________Cu(OH)2沉淀生成(填“有”或“无”)。
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80 mL混合,反应的离子方程式为_______________。
(10分)如下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol/L的硫酸,其他试剂任选。填写下列空白。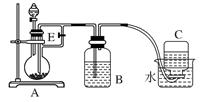
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是____________,A中反应的离子方程式是:_________。
(2)实验开始时就先将活塞E______(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程________________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:__________。
某学生利用下图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。按照实验步骤依次回答下列问题:
(1)导线中电子流向为____________(用a、b表示)。
(2)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________ (用“NA”表示);
(3)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
| A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动 |
| B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动 |
| C.盐桥中的K+、Cl-都向左侧烧杯移动 |
| D.盐桥中的K+、Cl-几乎都不移动 |
(4)若将反应2Fe3++Cu===Cu2++2Fe2+设计成原电池,写出电极反应式。
正极反应______________;
(5)下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式。
①电池总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag:__________。
②2C2H2+5O2 4CO2+2H2O:_________________。
4CO2+2H2O:_________________。
③6H2O+6CO2 C6H12O6(葡萄糖)+6O2:__________。
C6H12O6(葡萄糖)+6O2:__________。