从固体物质A开始,可以发生如下框图所示的一系列变化: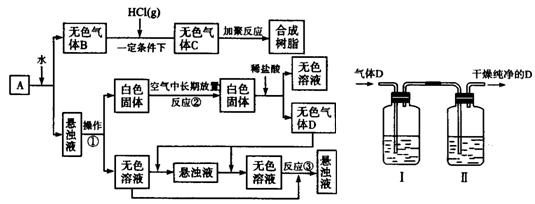
完成下面问题:
(1)在实验室中收集气体B的方法是 。
(2)操作①的名称是 。
在操作①中所使用的玻璃仪器的名称是 。
(3)写出反应②和反应③的化学方程式:
反应②
反应③ 。
(4)A的化学式是 。
(5)在实验室中,如要获得干燥纯净的气体D,可以将它通过如上右图所示的装置,其中瓶I中盛放的试剂是 ,瓶Ⅱ中盛放的试剂是 。
收集干燥气体D的方法是 。
氯碱工业中电解饱和食盐水的原理示意图如下图所示:
(1)溶液A的溶质是;
(2)电解饱和食盐水的离子方程式是;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)]。
精致流程如下(淡盐水和溶液A来自电解池):
①盐泥a除泥沙外,还含有的物质是。
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
④经过程Ⅲ处理,要求盐水中c 中剩余Na2SO3的含量小于5mg /L,若盐水b中NaClO的含量是7.45 mg /L ,则处理10m3盐水b ,至多添加10% Na2SO3溶液kg(溶液体积变化忽略不计)。
I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82-+ 2I-= 2SO42-+ I2(1)
平均反应速率的计算式为v(S2O82-)= 。
。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:2S2O32-+ I2 ="" S4O62-+ 2I-(2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
|
试剂 用量 (mL) |
0.20 mol·L-1(NH4)2S2O8溶液 |
20.0 |
10.0 |
b |
20.0 |
20.0 |
| 0.20 mol·L-1 KI溶液 |
20.0 |
20.0 |
20.0 |
10.0 |
5.0 |
|
| 0.010 mol·L-1 Na2S2O3溶液 |
a |
8.0 |
8.0 |
8.0 |
8.0 |
|
| 0.2% 淀粉溶液 |
2.0 |
2.0 |
2.0 |
2.0 |
2.0 |
|
| 0.20 mol·L-1KNO3溶液 |
0 |
0 |
0 |
10.0 |
c |
|
| 0.20 mol·L-1(NH4)2SO4溶液 |
0 |
10.0 |
15.0 |
0 |
0 |
|
| 20 ℃时,反应时间Δt(s) |
32 |
67 |
130 |
66 |
135 |
|
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 |
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是。
(3)第①组实验的v(S2O82-)=mol·(L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)
。
II.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:Na2CO3 + SO2= Na2SO3 + CO2;2Na2S + 3SO2 = 2Na2SO3 + 3S↓;
Na2SO3 + S= Na2S2O3。该小组根据上述原理设计下图所示装置制备Na2S2O3。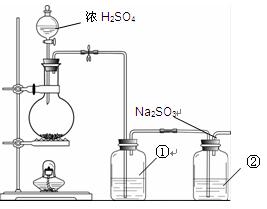
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是
①;
②。
(2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括:。
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+ H2O(g)="===" CO (g)+3H2(g)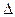 H =" +206.2" kJ·mol-1
H =" +206.2" kJ·mol-1
CH4(g)+ CO2(g)="===" 2CO (g)+2H2(g) 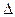 H =" +247.4" kJ·mol-1
H =" +247.4" kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_______________________________。
(2)电解尿素[CO(NH)]的碱性溶液制氢的装置示意图见图: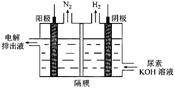 (电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极排出液中含有大量的碳酸盐成份,则阳极的电极反应式为_______,每消耗1mol尿素需要补充______mol氢氧化钾。
(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极排出液中含有大量的碳酸盐成份,则阳极的电极反应式为_______,每消耗1mol尿素需要补充______mol氢氧化钾。
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 =2CO2 +3H2O,电池示意如图: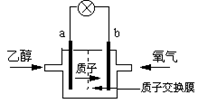
(1)_________极(填a或b)为电池的负极,电池工作时电流方向为______________;
(2)写出电池正极反应方程式___________________;
(3)电池工作时,1mol乙醇被氧化时就有________mol电子转移。
(1)选择适当的试剂除去下列物质中的少量杂质(括号内为杂质):
溴苯(溴):试剂______,反应方程式_________________________;
甲烷(乙烯):试剂______,反应方程式_________________________;
(2)选择合适的试剂鉴别下列物质:
苯和甲苯:试剂__________________________________;
乙烷和乙炔:试剂_____________________________________。