(1)下列有关实验操作或判断正确的是 (填序号,多选扣分)。
A.将配制好一定物质的量浓度的溶液,注入含有少量水的试剂瓶中,浓度不受影响。
B.用托盘天平称取5.85g氯化钠固体
C.苯、CCl4可用来萃取溴水中的溴。
D.需要95 mL 0.1 mol/L NaCl溶液,一般用100 mL容量瓶进行配制。
E.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量。
F.观察钾元素焰色反应的操作是:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,观察观察火焰的颜色。
(2)①容量瓶上含有下列量中的(填写字母)
A 压强 B 温度 C 容积 D 密度 E 刻度线
②用浓硫酸配制500mL2mol∙L-1硫酸溶液时,所需的玻璃仪器除烧杯、量筒、玻璃棒和胶头滴管之外,还需要 (填仪器名称);在下列配制过程示意图中,有错误的是 (填写序号。

③现要用容量瓶配制500mL0.4mol∙L-1Na2CO3溶液,配好的溶液倒入试剂瓶后需要贴上标签。请你帮助把下图标签上的内容填上去。

④下列情况将使配制溶液的物质的量浓度偏低的有 (填序号)。
A. 容量瓶用蒸馏水洗净后,未待干燥便用来配制
B. NaOH溶解后趁热移入容量瓶中
C. 定容时,俯视刻度线
D. 摇匀后发现液面未到刻度线,继续加水至刻度线
化学上常用燃烧法确定有机物的组成。下图装置是用燃烧法确定烃或烃的含氧衍生物分子式的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。(已知A中发生的反应为:2H2O2=2H2O+O2↑)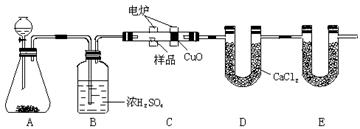
回答下列问题:
(1)C装置(燃烧管)中CuO的作用是。
(2)写出E装置中所盛放物质的名称,
它的作用是。
(3)若将B装置去掉会对实验结果造成什么影响?。
(4)若准确称取1.20 g样品(烃或烃的含氧衍生物)。经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的实验式为。
(5)从定量测定准确角度去考虑,该装置应怎样进一步改进
。
某学习小组按右图在实验室制取氨气并探究铜的有关性质(部分夹持仪器未画出)。
请回答:
(1)制取氨气的化学方程式是。
(2)① 实验现象为:黑色CuO变为红色(生成单质a);白色无水CuSO4粉末变为蓝色; 同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式。 ②碱石灰的作用是。
(3)将上述生成的单质a在热水浴中进行4个实验,部分实验报告如下表所示。
| 序号 |
实验操作 |
实验现象 |
| Ⅰ |
稀硫酸中加入该单质a |
无明显变化 |
| Ⅱ |
硝酸钠溶液中加入该单质a |
无明显变化 |
| Ⅲ |
硫酸钠溶液中加入该单质a |
无明显变化 |
| Ⅳ |
稀硫酸中加入硝酸钠溶液 |
无明显变化 |
| 再加入该单质a |
有无色气泡;溶液变蓝 |
①实验I、II、III的目的是。
②实验Ⅳ中反应的本质是(用离子方程式表示)。
③将该单质a加入到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是。
用2.4 mol/L的H2SO4溶液配制100mL浓度为0.2 mol/L的稀H2SO4,回答下列问题:
(1)需用量筒量取2.4 mol/L的H2SO4溶液的体积是mL。
(2)溶液配制的所需的基本步骤如下:
将上述实验步骤A到F按实验过程先后次序排列___________________。
(3)上述实验步骤A、B、E、F都用到的仪器名称为__________。
(4)取上述所配溶液10mL与足量BaCl2溶液反应,生成白色沉淀0.48 g。则该溶液
浓度0.2 mol/L(填“大于”“等于”或“小于”),造成此误差的操作可能
是。
a. 定容时俯视容量瓶; b. 用量筒取2.4 mol/LH2SO4溶液时俯视读数;
c. 容量瓶使用前未干燥;d. 使用的烧杯和玻璃棒未洗涤彻底;
e. 定容时将蒸馏水洒在容量瓶外面
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请回答下列问题:
(1)实验室制取氯气的反应原理为:MnO2+4HCl(浓)  MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
①该反应中被还原的元素是,还原剂是。
②取一定量的浓盐酸使其与二氧化锰反应,产生的氯气在标准状况下的体积为33.6 L,则被氧化的HCl的物质的量为,反应中转移电子数为。
(2)某同学用下列装置制备并检验Cl2的性质。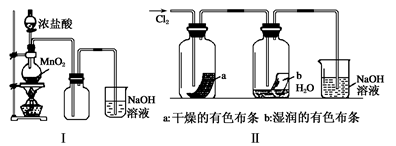

下列说法正确的是
a.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
b.Ⅱ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
c.Ⅲ图中:生成蓝色的烟
(3)若氯气罐发生泄漏,当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是。
a.NaOH b.NaCl c. KOH d. Na2CO3
(4)将SO2和Cl2分别通入装有品红溶液的两个试管中,两溶液的红色均褪去。加热后,有一支试管中的溶液又呈现红色,该试管通入的气体是。
将SO2和Cl2按1:1体积比(同温同压)混合后通入品红溶液中,溶液不褪色。为检验两种气体在溶液中是否发生了氧化还原反应,应向所得溶液加入的试剂是(填化学式)。经实验证明,SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是。
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是。
| 第1组 |
第2组 |
第3组 |
| S(单质) |
SO2、X、Na2SO3、NaHSO3 |
SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2-76.1℃,SO3 16.8℃;沸点:SO2-10℃,SO345℃)
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是。