(12分) 在实验室,可以用如图所示的装置制取乙酸乙酯。回答下列问题:
(1)右侧试管中的盛放的是 ,导气管的下端不能插入液面以下,其目的是 。
(2)写出实验室制取乙酸乙酯的化学反应方程式 ,该反应的类型是 。
(3)该反应是典型的可逆反应,若不把生成的乙酸乙酯及时蒸馏出来,反应一段时间后,就会达到化学平衡状态。下列能说明该反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水;
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸;
④正反应的速率与逆反应的速率相等;
⑤混合物中各物质的浓度不再变化。
某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
| A.移取20 mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.用标准溶液润洗滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2 cm |
E.调节液面至“0”或“0”以下某一刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)__________________;
(2)上述B步骤操作的目的是_______________________;
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是______________;
(4)判断到达滴定终点的实验现象是______________________;
(5)若滴定时在晃动锥形瓶的过程中不小心将液体洒出,对实验结果的影响是_______;
(6)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是__________________________________。
某烧碱溶液中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.在250ml的容量瓶中定容成250ml烧碱溶液; |
| B.用碱式滴定管取25ml烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂; |
| C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为Mmol/L的标准硫酸溶液装入酸式滴定管,调整液面,记下开始刻读数为V1ml |
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻读数为V2 ml
回答下列问题:
①正确的操作步骤的顺序是 → → →D→ .
②操作E中在锥形瓶下垫一张白纸的作用 。
③操作D中液面应调整到 ,尖嘴部分应 。
④滴定终点时瓶内溶液的PH约为 ,终点时颜色变化是 。
⑤若酸式滴定管没有用标准硫酸溶液润洗,会对测定结果有何影响? (填偏高、偏低、无影响,其他操作均正确)
⑥该烧碱样品的纯度计算式为 。
某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)上述(B)操作的目的是___________________________________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________。
(4)实验中用左手控制_________(填仪器及部位),眼睛注视_______,直至滴定终点。判断到达终点的现象是___________。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是___________________________________。
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是______。
甲酸钠广泛用作催化剂和稳定合成剂,印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。用电石炉废气(CO 75~90%,以及少量CO2、H2S、N2、CH4等)其合成部分工艺流程如下: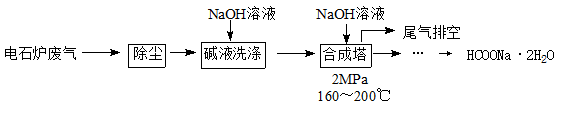
(1)上述工艺用碱液洗涤的目的是 ,可能发生的反应有 (列举两例)。
(2)上述合成工艺中采用循环喷射吸收合成,其目的是 ;最后排空的尾气主要成分是 。
(3) 合成时,得到的HCOONa溶液溶质质量分数约为5%,合成塔反应液中分离出HCOONa·2H2O的主要步骤有 、 、 ,再经洗涤干燥得到。
(4) 甲酸钠高温时分解制取草酸钠的化学方程式为 。
(5) 在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要工业产品保险粉(Na2S2O4)同时产生二氧化碳,该反应离子方程式为 。
羟基是重要的官能团。某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性。①碳酸②乙醇③苯酚④乙酸
I.甲同学设计并实施了如下实验方案,请完成(1)(2)(3)(4)的填空及结论。
| 编号 |
实验操作 |
实验现象 |
结论及解释 |
1 |
分别取4种溶液,滴加紫色石蕊溶液 |
溶液变红的是①④溶液 |
略 |
2 |
向含酚酞的NaOH溶液中,各滴加等量的②③两种溶液 |
②中无明显现象 ③中红色明显变浅 |
滴加③时反应的化学方程式:(1)___________ |
3 |
用一定浓度的醋酸溶液浸泡水垢(水垢主要成分为碳酸钙) |
(2)__________ |
略 |
4 |
将CO2通入C6H5ONa溶液中 |
(3)__________ |
反应的化学方程式: (4)_____________ |
| 结论: 4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)_____________。 |
II.乙同学在研究了甲同学的实验方案后,提出如下改进方案,能一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如下图所示。
(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)_______中,B管插入E中,C管插入_________中。
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有_____________溶液的洗气装置,使乙同学的实验设计更加完善。