Ⅰ.某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

请回答:
(1)装置A中蒸馏烧瓶生成SO2的化学方程式为: 。
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为: 。
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象: 。
Ⅱ.某化学兴趣小组为探究铜跟浓硫酸的反应,用图所示装置进行有关实验。请回答:
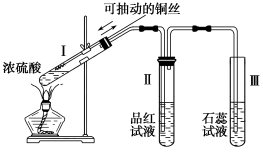
(4)试管Ⅰ中发生反应的化学方程式为:: 。
(5)下列实验不合理的是 。
A.上下移动Ⅰ中铜丝可控制生成SO2的量
B.Ⅱ中选用品红溶液验证SO2的生成
C.Ⅲ中可选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向Ⅰ加水,观察溶液颜色
(6)实验中,用ag铜片和VmL18.4mol·L-1的浓硫酸(98%)放在试管中共热,直到反应完毕,发现试管中还有铜片剩余,该小组学生认为还有一定量的硫酸剩余。
①有一定量的硫酸剩余但未能使铜片完全溶解,你认为原因是 。
②下列药品中能用来证明反应结束后的试管中确有硫酸剩余的是 (填序号)。
a.铁粉 b.BaCl2溶液 c.Ba(NO3)2溶液 d.Na2CO3溶液
(12)用A、B、C三种装置都可制取溴苯。请仔细分析三套装置,然后回答下列问题。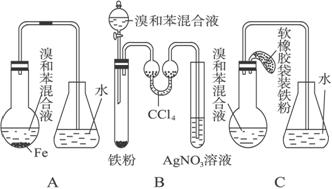
(1)写出三个装置中都发生的化学反应方程式_____________、_____________;写出B的试管中还发生的化学反应方程式_____________。
(2)装置A、C中长导管的作用是________。
(3)B、C装置已连接好,并进行了气密性检验,也装入了合适的药品,接下来要使反应开始,对B应进行的操作是__________,对C应进行的操作是_______________。
(4)A中存在加装药品和及时密封的矛盾,因而在实验中易造成的不良后果是______。
(5)B中采用了双球吸收管,其作用是______________;反应后双球管中可能出现的现象_______________;双球管内液体不能太多,原因是_________________________。
(6)B装置也存在两个明显的缺点使实验效果不好或不能正常进行。这两个缺点是________________________、________________________。
配制500 mL 0.5 mol/L的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为________。
(2)本实验必须用到的玻璃实验仪器除容量瓶、烧杯外,还有____________________________。
(3)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将____________________(填“高于”或“低于”)右边的托盘。假定最终称得小烧杯的质量为____________(填“32.6 g”或“32.61 g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程。
| 砝码质量/g |
50 |
20 |
20 |
10 |
5 |
| 称量(取用砝码)过程 |
(4)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温。
②继续往容量瓶中加蒸馏水至液面接近刻度线1 cm~2 cm。
③将NaOH溶液沿玻璃棒注入500 mL容量瓶中。
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶。
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作按正确顺序编出序号。
(5)某学生实际配制NaOH溶液的浓度为0.48 mol/L,原因可能是( )
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤
D.胶头滴管加水后定容时仰视刻度
按下图装置进行实验:
(1)实验一段时间后,可观察到锥形瓶口上方有白烟生成,请将可能观察到的其他现象补齐:;
有关化学方程式是
(2)由于气温的原因,上述实验一段时间后现象不太明显,需向锥形瓶内加入下列哪种物质才能看到明显现象(填代号)。
| A.氢氧化钠固体 | B.生石灰 | C.浓硫酸 | D.氯化铵固体 |
根据从草木灰中提取钾盐的实验,填写下列空白:
(1)此实验操作顺序如下:①称量样品,②溶解、沉淀,③,④,⑤冷却结晶。
(2)用托盘天平(指针向上的)称量样品,若指针偏右边,则表示。
| A.左盘重,样品轻 | B.左盘轻,砝码重 | C.右盘重,砝码轻 | D.右盘轻,样品重 |
(3)在进行第③步操作时,有时可能要重复进行,这是由于。
(4)在进行第④步操作时,有时要有玻璃棒不断小心地搅动液体,目的是防止。
(5)所得产物中主要钾盐有、、(填化学式)。
下面是实验室制取肥皂的实验步骤:①在蒸发皿中加入8mL植物油、8mL乙醇和4mLNaOH溶液;②把盛有混合物的蒸发皿放在冷水中冷却;③在不断搅拌下,给蒸发皿中的液体微微加热,直到混合物变稠;④向混合物中加入20mL热蒸馏水,再放在冷水中冷却;⑤加入25mLNaCl饱和溶液,充分搅拌;⑥继续加热,直到把一滴混合物放到水中时,在液体表面不再形成液滴为止;⑦用纱布滤出固体物质,弃去废液。把固体物质挤干,并压成条状,晾干,即制得肥皂。
(1)上述实验的正确操作步骤是。
(2)加入乙醇的作用是什么?
(3)加入饱和NaCl溶液的作用是什么?
(4)如何检验皂化反应是否完全?。
(5)写出上述制取反应的化学方程式。