红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
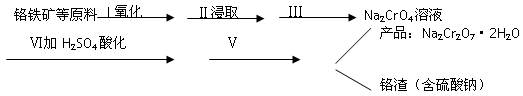
①步骤I中反应的化学方程式为:
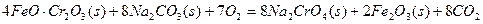 该反应的化学平衡常数的表达式为 ,在常温下该反应速度极慢,下列措施中能使反应速率增大的是 。
该反应的化学平衡常数的表达式为 ,在常温下该反应速度极慢,下列措施中能使反应速率增大的是 。
| A.升高温度 | B.通入过量的空气 | C.将原料粉碎 | D.增加纯碱的用量 |
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 、 。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为: 。
(2)将红矾钠与KCl固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格。完成上述过程。
| 序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
| ① |
溶解 |
将混合物放入烧杯中,加水,充分搅拌直到固体不再溶解。 |
| ② |
|
|
| ③ |
|
|
| ④ |
|
|
| ⑤ |
过滤、干燥 |
得到K2Cr2O7晶体 |
一种溶液里可能含有OH-、Cl-、CO 、SO
、SO 四种离子中的一种或几种。取少量这种溶液分别盛于三支试管中,进行如下实验:
四种离子中的一种或几种。取少量这种溶液分别盛于三支试管中,进行如下实验:
(1)向第一支试管中滴入酚酞试液,溶液变红。
(2)向第二支试管中加入Ba(NO3)2溶液,有白色沉淀生成。
(3)向第三支试管中逐滴加入稀HNO3溶液,有无色气体生成,该气体能使澄清石灰水变浑浊;继续加入稀HNO3使溶液呈酸性时,再加入Ba(NO3)2溶液不产生沉淀。
试判断:该溶液中肯定含有___________离子,肯定没有___________离子,不能肯定有没有的是_________离子。(每空2分,共6分)
(8分)实验员不慎忘了给新配制的溶液贴标签,只知道这四瓶液体是:蛋白质溶液、淀粉溶液、淀粉酶溶液和蒸馏水。现有碘试剂和三氯乙酸(会使蛋白质变性,蛋白质溶液变浑浊),请你用这两种试剂,以最佳方法和步骤区分四种未知溶液。
(9分)分别设计化学实验,用最佳方法证明明矾溶于水时发生的下列变化:
供选用的药品和仪器:明矾溶液、甲基橙试液、酚酞试液、pH试纸、NaOH溶液、酒精灯、半透膜、电泳仪、聚光束仪等。
(1)证明明矾发生了水解反应:。
(2)证明其水解反应是一个吸热反应:。
(3)证明生成了胶体:。
实验室可用右图所示装置进行CO和CO2混合气体的分离和干燥。已知a为止水夹,b为分液漏斗丙的活塞。可供选用的试剂有NaHCO3溶液、NaOH溶液、浓硫酸、无水氯化钙、稀硫酸。试回答: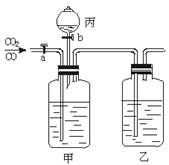
(1)广口瓶甲中应放的试剂为___________,广口瓶乙中应放的试剂为___________,分液漏斗丙中应放的试剂为___________。
(2)第一步应先分离出______,分离时应先关闭______,打开______,发生反应的离子方程式是_____________。
(3)第二步分离出_____________时,先关闭_____________,打开___________,发生反应的离子方程式为______________________。
某钠盐溶液可能含有阴离子
,
,
,
,
,
,
。为鉴定这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加
后,生成无色无味气体。该气体能使饱和石灰水溶液变浑浊;
③加
,滴加少量氯水,振荡后,
层未变色;
④加
溶液产生白色沉淀,分离,在沉淀中加人足量盐酸,沉淀不能完全溶解;
⑤加
酸化后,再加过量
,溶液中析出白色沉淀。
(1)分析上述 5 个实验,写出每一实验鉴定离子的结论与理由。
实验①;
实验②;
实验③;
实验④;
实验⑤;
(2)上述 5 个实验不能确定是否存在的离子是。