现用如下实验装置测定铜和氧化铜混合物中铜元素的含量。
试回答下列问题:
(1)A中盛装盐酸的仪器名称为 。
(2)A中可观察到的现象为 。
(3)B装置的作用是 。
(4)在给D装置加热前,应该进行的一步操作是 ,其目的是:
。
(5)已知D装置中铜和氧化铜混合物的质量为10 g,经称量,反应前后E装置的质量分别为100.2 g和102.0 g,原混合物中铜元素的质量分数为 (假设各装置中的反应或吸收都是完全的)。
(6)如不加F装置,会使实验结果 (填“偏低”或“偏高”)。
如图所示是中学化学实验中常见的装置,它有多种用途。
(1)若瓶中装有X溶液,将CO和CO2的混合气体由a管口通入,用以除去CO2,则X为________。
| A.H2SO4 | B.NaOH | C.NaCl | D.HCl |
(2)若用排水法收集H2,则H2气体应从_______(填标号,下同)管口导入;若用排空气法收集CO2,则CO2气体应从________ 管口导入。
(3)医院里给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装有水的该装置,观察气泡产生的情况,以便调节供氧速率,此时氧气应从管口导入。
可用于分离或提纯物质的方法有:①过滤②蒸馏③加热④分液⑤结晶法⑥蒸发⑦萃取(填序号)
(1)除去石灰水中悬浮的CaCO3颗粒
(2)除去NaCl晶体中混有的碘单质
(3)分离石油中各不同沸点范围的成分
(4)分离水和CCl4的混合物
(5)除去 KCl 中少量 KClO3
(6)CCl4与甲苯的混合物
(已知CCl4与甲苯互溶,沸点分别为76.75 ℃和110.6 ℃)
(7)提取NaCl和KNO3混合溶液中的KNO3
下图中各仪器的名称分别是:
某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:
(1)实验时,过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为。
(2)洗涤沉淀B的操作是_______________________________________
_________________________________________________________________。
(3)在整个实验过程中托盘天平至少使用_____次。
(4)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为_____________。
方案Ⅱ.乙组同学的主要实验流程图如下: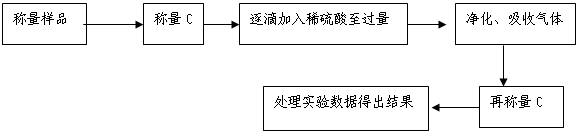
按如下图所示装置进行实验:
(5)该实验中装置B盛放的物质是_____________________,分液漏斗中(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(6)在C中装碱石灰来吸收净化后的气体。
①样品中碳酸钠的质量分数越大,则实验中吸收净化后气体的干燥管在充分吸收气体前后的质量差____ __。(填“越大”、“越小”或“不变化”)
②D装置的作用是______________ _ _________。
(7)有的同学认为为了减少实验误差,在反应前后都要通人N2(如图),反应后通入N2的目的是。
(9分) 下图表示从固体混合物中分离X的2种方案,请回答有关问题。

(1)选用方案I时,X应该具有的性质是,残留物应该具有的性质是;
(2)选用方案Ⅱ从某混合物(含有Al2O3和MgO)中分离MgO,加入的试剂是,有关离子反应方程式为。