下图所示装置进行有关实验,将A逐滴加入B中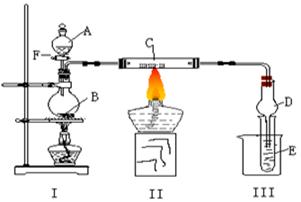
⑴若A是实验室的一种常用燃料,B是生石灰,实验中观察到C中黑色固体逐渐变红,当C中黑色固体大部分变红时,关闭F,然后往烧杯中加入热水,静止一会,观察到III中试管壁出现了光亮的银镜,则A是 ,C是 ,请写出反应管C中所发生的反应方程式: 。试管E中所发生反应的离子方程式: 。
⑵若I处酒精灯不加热, B、C仍是实验(1)中原物质,实验中也观察到C中黑色固体逐渐变红,同时可观察到E中溶液先形成沉淀,然后沉淀溶解,并有一种无色无味的气体逸出,当溶液恰好澄清时,关闭F,然后往烧杯中加入热水,静止一会,观察到III中试管壁也出现了光亮的银镜,则A是 ,E中是 与葡萄糖的混合液(写化学式)。请写出反应管C中所发生反应的方程式: 。仪器D在此实验中的作用是 。
⑶若B为浓硫酸,E为苯酚钠溶液,C仍旧不变,A是只含一个碳的一种有机物也能发生银镜反应,实验中同样能观察到C中黑色固体逐渐变红,同时可观察到试管中溶液变浑浊,则A可能是 ,然后往烧杯中加入沸水,可观察到试管中的现象是 ,此实验中浓硫酸的作用是 。写出(1)中A和(3)中A二种物质在浓硫酸存在时所发生的反应方程式: ,此反应中浓硫酸的作用是 。
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如图。根据要求填空:
(1)写出CH4与Cl2生成一氯代物的化学反应方程式 。
(2)B装置有三种功能:①控制气体流速;②将气体混合均匀;③ 。
(3)D装置中的石棉上吸附着KI饱和溶液及KI粉末,其作用是。
(4)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为。
(5)该装置还有缺陷,原因是没有进行尾气处理,尾气的主要成分是。(填编号)
| A.CH4 |
| B.CH3Cl |
| C.CH2Cl2 |
| D.CHCl3 |
E.CCl4
为证明化学反应有一定的限度,进行如下探究活动: I.取5m1 0.1mol/L的KI溶液,滴加几滴FeCl3稀溶液(已知:2Fe3++2I-=I2+2Fe2+) Ⅱ.继续加入2ml CCl4振荡. Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为;
探究活动Ⅱ的实验现象为。
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+;
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大,Fe(SCN)3在乙醚中与在水中呈现的颜色相同;
信息二:Fe3+可与[Fe(CN)6] 4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高。结合新信息,现设计以下实验方案验证猜想:
ⅰ.请完成下表实验操作、现象和结论
| 实 验 操 作 |
现 象 和 结 论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] |
若产生①, 则②不成立; |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 |
若③, 则④成立; |
ⅱ.写出实验操作“步骤一”中反应的离子方程式为。
(10分)工业上可以利用含铝、铁、铜合金的废料获得绿矾(FeSO4·7H2O)、胆矾等,甲同学设计的实验方案如下:
请回答:
(1)操作①、操作②所用的玻璃仪器是;沉淀C的化学式为。
(2)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选):。
(3)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是。
(4)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和H2O2制胆矾晶体,则反应④的离子化学方程式为。
(12分)某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2·6C2H5OH。请回答下列问题:
(1)制备乙酸乙酯装置如图所示,虚框内玻璃仪器名称为;冷凝水流经冷凝管时应从口进入(填“a”或“b”);
(2)生成乙酸乙酯的化学反应方程式为;
(3)下列措施可提高乙酸的转化率可采取的有( )
A.增加乙醇的用量 B.蒸出乙酸乙酯
C.增加乙酸的用量 D.冷凝管中通热水
(4)实验所得乙酸乙酯远低于理论产量的可能原因。(写出其中两种)
(5)为了除去粗产品其中的醋酸,可向产品中加入溶液,在分液漏斗中充分振荡,然后静置,待分层后(填选项)。
A.直接将有机层从分液漏斗上口倒出
B.直接将有机层从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将有机层从下口放出
D.先将水层从分液漏斗的下口放出,再将有机层从上口倒出
(6)再向得到的有机物粗产品中加入饱和氯化钙溶液,振荡、分离。加入饱和氯化钙溶液的目的是。
(7)最后,加入干燥剂除去其中的水分,再进行(填操作),即可得到纯净的乙酸乙酯。
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3 ,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。请填写下列空白: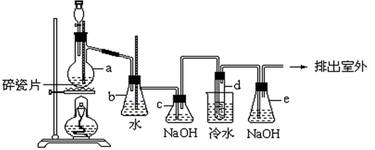
(1)烧瓶a中发生的是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速升高到170℃,否则容易产生副反应。请你写出乙醇的这个消去反应方程式:。
(2)写出制备1,2-二溴乙烷的化学方程式。
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象。
(4)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因(写出一条)。
(5)c装置内NaOH溶液的作用;e装置内NaOH溶液的作用是。