高纯度的单质硅是信息产业的核心资源,没有硅就没有你喜欢的计算机。在地壳中含有大量的硅元素,含量仅次于氧,但自然界中没有游离的硅,硅元素全部是以化合态的形式存在的。工业上主要是利用碳与二氧化硅在高温下反应制备粗硅,某校化学兴趣小组对该反应中气体产物的成分进行探究。
(1)该兴趣小组对气体产物的成分提出如下假设,请你完成假设二和假设三:
假设一:气体产物只有CO;
假设二:____________________;
假设三:_____________________。
……
(2)为探究气体的成分,该兴趣小组设计了如下实验装置:
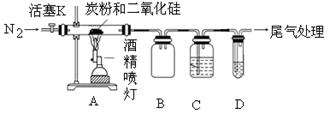
已知:PdCl2溶液可用于检验CO,反应的化学方程式为:CO+PdCl2+H2O=CO2+2HC1 +Pd↓(产生黑色金属钯粉末,使溶液变浑浊);
为避免空气中的氧气、二氧化碳、水蒸气对实验产生干扰,实验时要求通入足够长时间的氮气。
供选试剂:澄清石灰水、PdCl2溶液、浓硫酸、NaOH溶液。
①装置B的作用是______________;
②请你根据上述装置,设计实验验证假设一,写出实验步骤和结论(解答时要求指明C、D中所选试剂的名称):
| 实验步骤(不要求写出具体操作过程) |
实验预期现象和结论 |
| |
|
(3)有人认为,气体产物的成分与两种反应物的质量之比有关。为了探究炭粉不足时生成物中气体的成分,反应物中炭粉与二氧化硅的质量之比的最大比值是_________。
(4)资料表明,炭粉过量时会生成副产物SiC,若生成物中Si与SiC的物质的量之比为1:2(假定气体产物只有CO),写出该反应的化学方程式:________________________。
利用铝热反应焊接钢轨的原理是2Al+Fe2O3 2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
样品处理:将褐色硬块处理成粉末状。
(1)研究小组首先取少量粉末加入溶液中,发现粉末部分溶解,但没有气泡产生,实验结论是:粉末中含有Al2O3而没有Al。
(2)根据以述实验判断该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3。
提出假设:
假设1:固体粉末中除Al2O3外还有Fe;
假设2:固体粉末中除Al2O3外还有;
假设3:固体粉末中除Al2O3外还有Fe和Fe2O3。
实验实施:
(3)请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3mol/LNaOH、3mol/LHCl、3mol/LHNO3、3mol/LCuSO4、0.01mol/LKMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。
| 实验操作 |
预期现象和结论 |
 步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤。 步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤。 |
|
| 步骤2:将步骤1的滤渣转移到烧杯B中,加入足量,充分搅拌,过滤,洗涤。 |
有红色固体生成,说明粉末中含有 。 |
| 步骤3:将步骤2的滤渣转移到烧杯C中, 。 |
, 说明粉末中含有Fe2O3。(1分) |
某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。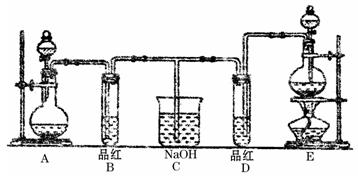
(1)实验室常选用制CO2的发生装置制SO2,实验室用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中装置(填装置序号)制Cl2,通过(填写仪器名称)向烧瓶中加入适量的浓盐酸,反应离子方程式为
。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个试管加热,两个试管中的现象分别为
B:,
D:。
(3)甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。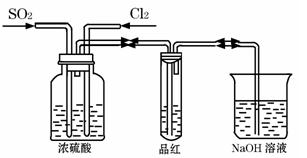
甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是(用化学反应方程式表示):
某同学用标准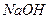 溶液来测定未知浓度的盐酸的浓度:
溶液来测定未知浓度的盐酸的浓度:
(1)配制250mL 0.5mol/L的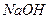 溶液所需的玻璃仪器为。
溶液所需的玻璃仪器为。
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用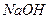 溶液滴定到终点。
溶液滴定到终点。
该同学进行了三次实验,实验数据如下表:
| 实验编号 |
盐酸的体积(mL) |
标准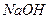 溶液的体积(mL) 溶液的体积(mL) |
| 1 |
20.00 |
18.20 |
| 2 |
17.10 |
|
| 3 |
16.90 |
滴定中误差较大的是第次实验,造成这种误差的可能原因是(填选项编号)
a、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
b、滴定管在盛装标准 溶液前未润洗
溶液前未润洗
c、滴定开始前盛装标准 溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
d、滴定开始前盛装标准 溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、达到滴定终点时,俯视溶液凹液面最低点读数
g、滴定到终点时,溶液颜色由无色变到了红色
(3)该同学所测得盐酸的物质的量浓度为(结果保留三位小数)。
根据下式所示的氧化还原反应设计一个原电池:
(1)装置可采用烧杯和盐桥,画出此原电池的装置简图。
①注明原电池的正极和负极;
②注明外电路中电子的流向。
(2)写出两个电极上的电极反应。
)X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,一般情况下X的单质只有氧化性。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究YX2和W2的性质。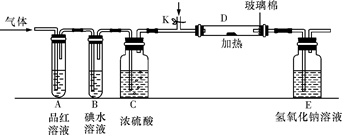
①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”) ;若装置D中装的是铁粉,当通入W2时D中观察到的现象为 ;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母) ,可以看到白色沉淀生成。
| A.氨水 | B.稀盐酸 |
| C.稀硝酸 | D.氯化钙 |
(4)若由元素Y和X组成-2价酸根Z,Z中Y和X的质量比为Y∶X=4∶3,当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出W2与Z的溶液完全反应产生浅黄色沉淀的离子方程式