铝是自然界中含量最高的金属元素,以铝土矿(主要成分为Al2O3,还含有Fe2O3)为原料通过以下途径制备氯化铝晶体和绿矾晶体:
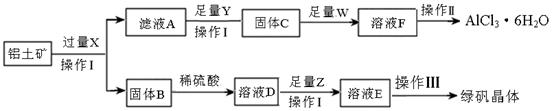
(1)X是__________,操作I是_______。
(2)Z是_____,检验溶液E中含有金属阳离子的实验方法是_______________________。
(3)操作Ⅱ的主要实验步骤是边滴加____(填试剂名称)边蒸发浓缩、冷却结晶、过滤、洗涤。
(4)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g) △H=a kJ·mol-1
3AlCl(g) =2Al(l)+AlCl3(g) △H=b kJ·mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示);
(5)铝电池性能优越,海洋灯塔电池是利用铝、石墨为电极材料,海水为电解质溶液,构成电池的其正极反应式为_______________________________;与铅蓄电池相比.释放相同电量时,所消耗金属电极材料的质量比m(Al):m(Pb)=____________。
(6)测定绿矾产品中Fe2+含量的实验步骤:
a.称取5.7g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
①计算上述产品中FeSO4•7H2O的质量分数为________;
②若用上述方法测定的产品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有___________(只回答一条即可)。
X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的氢
化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。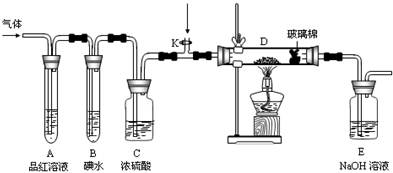
①分别通入YX2和W2,在装置A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为 ;若装置D中装的是五氧化二钒,当通入足量YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 E.双氧水 F.硝酸银 |
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下: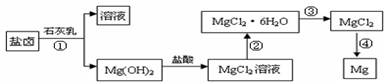
回答下列问题:
(1) 工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是
。
(2) 从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经 、 (填操作方法)可得纯净的Mg(OH)2。
(3)下图是该兴趣小组设计进行过程③的实验装置图: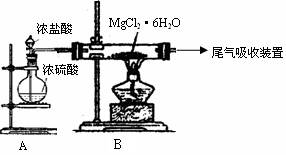
其中装置A的作用是 。
(4)写出过程④中发生反应的化学方程式 。
下列实验操作或对实验事实的描述正确的是(填序号)
①仅用蒸馏水可鉴别出蔗糖、硫酸铜、碳酸钙三种粉末;
②实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉;
③配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏低;
④用瓷坩埚熔化各种钠的化合物;
⑤分液时,先从分液漏斗中倒出上层液体,后放出下层液体;
⑥测溶液大致的pH:用玻璃棒蘸取溶液滴在湿润的pH试纸上,与标准比色卡对照;
⑦向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同;
⑧分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积前者少,后者多。
有A、B、C、D、E、F、G 7瓶不同物质的溶液,它们各是Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、Ca(NO3)2和Ba(OH)2溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如表所示。表中“↓”表示生成沉淀和微溶化合物,“―”表示观察不到明显变化。试回答下面问题。
| A |
B |
C |
D |
E |
F |
G |
|
| A |
― |
― |
― |
― |
― |
― |
↓ |
| B |
― |
― |
― |
― |
↓ |
↓ |
↓ |
| C |
― |
― |
― |
↓ |
― |
↓ |
↓ |
| D |
― |
― |
↓ |
― |
↓ |
↓ |
↓ |
| E |
― |
↓ |
― |
↓ |
― |
↓ |
― |
| F |
― |
↓ |
↓ |
↓ |
↓ |
― |
↓ |
| G |
↓ |
↓ |
↓ |
↓ |
― |
↓ |
― |
A的化学式是 ,G的化学式是 。判断理由是 。
写出其余几种物质的化学式。B ,C ,D ,E ,F 。
某化学研究性学习小组探讨Fe3+和SO32-之间发生怎样的反应,请你一起参与并协助他们完成实验。
⑴提出猜想:
甲同学认为发生氧化还原反应,其反应方程式为;
乙同学认为发生双水解反应,其反应方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3;……
⑵实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质,应选用的试剂是。
②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
⑶得出结论:
①根据丙同学的实验得出的结论是:;
②实验③中溶液变成血红色的离子方程式为。
⑷拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解能力较CO32-小外,还有。