(NH4)2SO4是常用的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
【查阅资料】(NH4)2SO4在260℃和400℃时分解产物不同。
【实验探究】该小组拟选用如图所示装置进行实验(夹持和加热装置略)
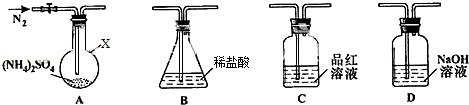
实验1:连接装置A﹣B﹣C﹣D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸 70.00mL)通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2.品红溶液不褪色。取下装置B,加入指示利.用0.2000moI/LNaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00mL,经检验滴定后的溶液中无SO42﹣。
(1)仪器X的名称是 .
(2)滴定前,下列操作的正确顺序是 (填字母编号).
a.盛装 0.2000mol/LNaOH溶液
b.用0.2000mol/L NaOH溶液润洗
c.读数、记录
d.查漏、清洗
e.排尽滴定尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是 .
实验2:连接装置A﹣D﹣B,检查气密性.按图示重新加入试剂;通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物。停止加热,冷却.停止通入N2,观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32﹣无SO42﹣。进一步研究发现,气体产物中无氮氧化物.
(4)检查装置D内溶液中有SO32﹣ 、无SO42﹣的实验操作和现象是 .
(5)装置B内溶液吸收的气体是 .
(6)(NH4)2SO4在400℃分解的化学方程式是 .
学生利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)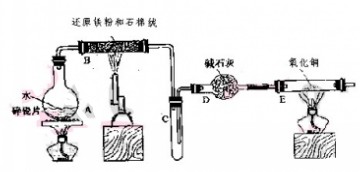
(1) 回答下列问题:所用铁粉中若有杂质,欲除去不纯铁粉中混有的铝粉可以选用的试剂为__ __(填序号)。
| A.稀盐酸 | B.氢氧化钠溶液 | C.浓硫酸 | D.FeCl3溶液 |
经除杂后的铁粉进一步干燥后装入反应容器。
(2)反应发生后装置B中发生反应的化学方程式是___________________。
D装置的作用:_______________________.
(3)该小组学生把B中反应后的产物加入足量的盐酸,过滤,用上述滤液制取FeCl3·6H2O晶体,设计流程如下: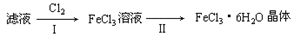
①步骤I中通入Cl2的作用
(填:氧化剂,还原剂,氧化产物,还原产物)
②为了检验某未知溶液是否是FeCl2溶液,同学们设计了以下实验方案加以证明。
向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液。你认为此方案是否合理(填”合理”或”不合理”)。
实验室用下图装置制取少量溴苯,试填写下列空白。
(1)在烧瓶a中装的试剂是、、。
(2)请你推测长直导管b的作用:一是,二是 的作用。
(3)请你分析导管c的下口可否浸没于液面中?为什么?
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有褐色不溶于水的液体,这可能是因为 的缘故。简述获得纯净的溴苯应进行的实验步骤:
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物物分子式的常用装置。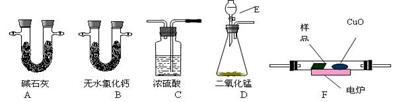
 (1)现准确称取0.44 g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88 g,B管增重0.36g。请回答:(1)按上述所给的测量信息,装置的连接顺序应是
(1)现准确称取0.44 g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88 g,B管增重0.36g。请回答:(1)按上述所给的测量信息,装置的连接顺序应是 ;
;
(2)A、B管内均盛有有固态试剂,A管的作用是_________;
(3)E中应盛装什么试剂:_________;
(4)如果把CuO网去掉,A管重量将_______;(填“增大”、“减小”、或“不变”)
(5)请改进这套装置的一个不足之处;(6)该有机物的实验式为_____________;
(7)要确定该有机物的分子式,还必须知道的数据是___________。(填编号)
①消耗液体E的质量②样品的摩尔质量③ CuO固体减少的质量④ C装置增加的质量
⑤燃烧消耗O2的物质的量
(共16分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。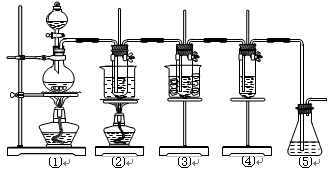
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:____________________________。
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。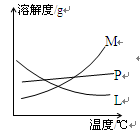
(3)本实验中制取次氯酸钠的离子方程式是______________________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 |
原因 |
| 溶液最初从紫色逐渐变为_______色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
_______________________________ |
| 然后溶液从无色逐渐变为_______色 |
_______________________________ |
(共14分)已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、CO32-。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成;
②D和B反应生成的气体能被A吸收;
③A和D反应生成的气体能被B吸收。
试回答下列问题:
(1)D的化学式是,判断理由是。
(2)写出其余几种物质的化学式:A,B,C。
(3)写出实验②中有关反应的离子方程式
。