工业制备高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
①KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是______(填代号)。
a、84消毒液(NaClO溶液) b、双氧水 c、苯酚 d、75%酒精
②高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a、浓硝酸 b、硝酸银 c、氯水 d、烧碱
③上述流程中可以循环使用的物质有 、 (写化学式)。
④若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
⑤该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2,所需试剂最好选择(选填代号) 。a、石灰石 b、稀HCl c、稀H2SO4 d、纯碱
⑥操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体。
溴系阻燃剂是目前世界上最大的有机阻燃剂。其主要品种之一“八溴醚”被广泛地用于聚乙烯、聚丙烯等聚烯烃类高聚物制品中,以达阻燃的作用。八溴醚的合成路线如下:
(1)请写出A、B、C的结构简式:A_____________,B____________,C__________。
(2)第①步反应属于_______________(填反应类型)。
(3)第②步反应的化学方程式_____________________________。
下图是常见物质间的反应关系,其中并且部分产物已被略去。常温下X为固体、B为液态,其余为气体。X受热分解生成A、B、C的物质的量相等。根据图中关系:
(1)推断化学式:X________;A________;B________;D________。
(2)写出CE反应的化学方程式______________________________________。
(3)写出X→A反应的离子方程式______________________________________。
(4)治疗心绞痛的药物三硝酸甘油酯,在人体体液中的酶的作用下,缓慢氧化自发释放出D分子,同时生成二氧化碳和水,写出该反应的化学方程式:_____________________。
已知在0.1mol·L-1的NaHSO3溶液中有关微粒浓度由大到小的顺序为:[Na+]>[HSO3-]>[SO32-]>[H2SO3]。则:
(1)则该溶液中[H+]____[OH-](填“<”“>”“=”),简述理由(用离子方程式表示)____。
(2)现向NH4HSO3溶液中,逐滴加入少量含有酚酞的氢氧化钠溶液,可观察到的现象是_____________________;写出该反应的离子方程式_________________。
已知烯烃在酸催化剂作用下水化或加聚时,氢原子都容易加到含氢较多的双键碳原子上。如: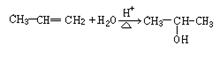
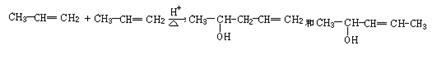
请只用2-甲基丙烷为有机原料,配用其它必要的无机物,按图示四步反应流程合成产品2,4,4-三甲基-2-戊醇[CH3C(CH3)(OH)CH2C(CH3)3]
请回答下列问题。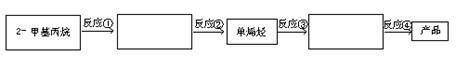
(1)对应填写各步反应的类型②,④。
(2)写出第④步反应得到产品的所有反应式。
(3)为什么本合成的转化率高?。
已知A、B、C、D、E五种芳香化合物的分子式都是C8H8O2,请分别写出它们的可能结构简式,使其满足下列条件:
A水解后得到一种羧酸和一种脂肪醇
B水解后得到一种羧酸和一种芳香醇
C水解后得到一种羧酸和一种酚
D水解后得到B中的羧酸和一种酚,但这种酚跟由C水解得到的酚不是同分异构体
E是苯的一取代衍生物,可以发生银镜反应
则结构简式:ABCDE。