白酒、食醋等均为家庭厨房中常用的物质,利用这些物质能完成下列实验的是( ) ①检验自来水中是否含氯离子 ②鉴别食盐和小苏打
③蛋壳能否溶于酸 ④白酒中是否含甲醇
| A.①② | B.①④ | C.②③ | D.③④ |
COCl2(g) CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压
⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
| A.①②④ | B.①④⑥ | C.②③⑤ | D.③⑤⑥ |
在密闭容器中发生下列反应aA(g )cC(g)+d D(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
)cC(g)+d D(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.a<c+d | D.D的体积分数变大 |
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) 2Z(g)+W(s)ΔH <0,下列叙述正确的是
2Z(g)+W(s)ΔH <0,下列叙述正确的是
| A.平衡常数K值越大,X的最大转化率越大 |
| B.达到平衡时,反应速率v正(X)=2v逆(Z) |
| C.达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数 |
| D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动 |
下图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图象,
2C(g)(正反应为放热反应)的平衡移动图象,
影响平衡移动的原因可能是
| A.升高温度,同时加压 |
| B.降低温度,同时减压 |
| C.增大反应物浓度,同时减小生成物浓度 |
| D.增大反应物浓度,同时使用催化剂 |
在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是
A.CH3OH(l)+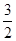 O2(g)===CO2(g)+2H2O(l)ΔH =+725.8 kJ/mol O2(g)===CO2(g)+2H2O(l)ΔH =+725.8 kJ/mol |
| B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH =-1452 kJ/mol |
| C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O (l)ΔH =-725.8 kJ/mol |
| D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH =+1452 kJ/mol |