海洋面积占地球总面积的71% 。海洋中含有丰富的资源,海水中的钠盐、镁盐等都是重要的化工原料,从海水中提取铀、重水对一个国家来说具有战略意义。
(1)写出镁元素在周期表中的位置:
(2)氯化钠的电子式 ,用电子式表示水的形成过程
(3)写出重水中的氢元素的核素符号:
写出下列化合物作为单体聚合生成的高分子化合物的结构简式:
(1)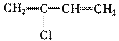 聚合得___________________________。
聚合得___________________________。
(2)已知 在虚线处开环聚合得
在虚线处开环聚合得 CH2CH2O
CH2CH2O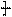 n,则
n,则 开环聚合得_______________________________。
开环聚合得_______________________________。
已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如右图。1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为。
存在于茶叶的有机物A,其分子中所含的苯环上有2个取代基,取代基不含支链,且苯环上的一氯代物只有2种。A遇FeCl3溶液发生显色反应。F分子中除了2个苯环外,还有一个六元环。它们的转化关系如下:
(1)有机物A中含氧官能团的名称是_________。写出X的结构简式_____________。
(2)写出A→B反应的化学方程式:____________________________________。
(3)A→C的反应类型为____________ __,E→F的反应类型为______________。
__,E→F的反应类型为______________。
(4)1mol A可以和____________molBr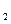 反应。
反应。
(5)某营养物质的主要成分(分子式为C16H14O3)是由A和一种芳香醇R发生酯化反应生成的,则R的含有苯环的同分异构体有__________种(不包括R)。
(6)A→C的过程中还可能有另一种产物C1,请写出C1在NaOH水溶液中反应的化学方 程
程 式:_________________________________________________________________。
式:_________________________________________________________________。
A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,甲、乙、丙为常见化合物。它们之间有如下转化关系。请回答:
(1)工业上冶炼B的常用方法为______________(填字母)
a.电解法 b.热还原法 c.热分解法
(2)丙的水溶液显性(填酸或碱),原因是(用离子方程式表示)
。
(3)D与甲溶液反应的化学方程式 。
(4)将C单质通入KI的碱性溶液中,可生成碘盐中的一种添加剂,试写出其反应的离子方程式:__________________________________________________。
(5)一定条件下,2molB与3molD的氧化物W恰好反应,则W的化学式。
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,。回答下列问题:
(1)写出一由A与C元素形成的阳离子的结构式___________;A、B、C、E四种元素都能与D元素形成原子个数比1:1化合物, 其中既含离子键,又含非极性共价键的是______________________(写化学式)
(2)A、B、D、E四种元素组成的某无机盐,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式
______________________________________________________________________。
(3)常温下,X、Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+ 浓度之比是_______________________________。
(4)1mol B的固体单质甲转化为1molB的另一种固体单质乙,吸收热量a kJ,已知甲的燃烧热为b kJ/mol,则乙的燃烧热为_______________________。
(5)化学反应:3A2(g)+C2(g) 2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),右图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________。温度为T ℃时,将4a mol A2和2a mol C2放入密闭容器中,充分反应后测得平衡混
2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),右图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________。温度为T ℃时,将4a mol A2和2a mol C2放入密闭容器中,充分反应后测得平衡混 合气中CA3的体积分数为50%,则此时C2的转化率为______________。
合气中CA3的体积分数为50%,则此时C2的转化率为______________。