(12分)右图是铜锌原电池装置。其电池的总反应是:
Zn(s) + CuSO4(aq)="=" ZnSO4(aq) + Cu(s)。
请回答以下问题: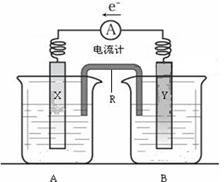
(1)R的名称是__________________,R中的阳离子移向_______(填A或B)中的溶液。
(2)电极Y的材料是________,B中的电解质溶液是________________。
(3)X为原电池的______极,其电极反应式是____________________________。
桂皮酸是一种可从安息香分离出的有机芳香酸,其苯环上只有一个取代基。桂皮酸甲酯可用作定香剂,用于饮料、冷饮、糖果、酒类等食品。G为桂皮酸甲酯的一种同分异构体,其分子结构模型如右图所示(图中球与球之间连线表示单键或双键)。用烃A 为原料合成G的路线如下: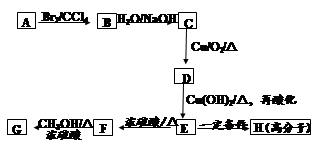
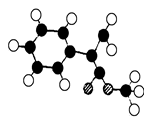
(1)桂皮酸结构简式为:;分子中核磁共振氢谱共有个峰;
(2)化合物D可以发生的反应有。
| A.取代反应 | B.氧化反应 | C.还原反应 | D.水解反应 |
(3)写出化学方程式
①C→D ____________________________
②E→H ____________________________
(4)其中E的同分异构体甚多,其中有一类可用通式 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式、、、。
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式、、、。
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D 是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。请回答下列问题:
(1)E+离子基态时的电子排布式为_______________
(2)A2F的分子空间构型为_____________,FO3分子中F原子的杂化方式 ______________
(3)CA3极易溶于水,其原因主要是______________
(4)从图中可以看出,D 与B形成的离子化合物的化
学式为______________(用元素符号表示),该离子晶体的
密度为ag·cm-3,则晶胞的体积是____________(写出表达式即可,不用化简)
(5)已知E单质的晶体为面心立方最密堆积 (在晶胞的顶点和面心均含有一个E原子),则 E的晶体中E原子的配位数为
用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、 Mg2+、 Ca2+、Cu2+等)制备氯化锌的一种流程如下: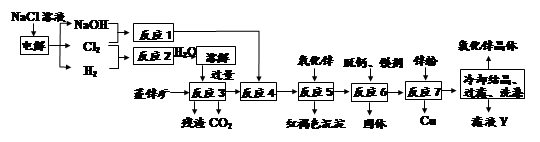
(1)在反应3前要将菱锌矿研磨,其目的是_______________________________
(2)反应4将Fe2+氧化为Fe3+,该反应的离子方程式为______________________
(3)加入氧化锌调节pH=4.5,反应5的离子方程式为________________________
(4)锌粉不在反应4之前加的原因是____________________________________
(5)若用石墨作电极电解滤液Y,则可以得到参与本流程反应的物质有_________
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)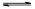 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需 时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验2条件下平衡常数K=。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正V逆(填“<” ,“>” ,“=”)。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系;
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。
CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10-4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为mo1/L 。
某金属(A)在TK以下晶体的基本结构单元如左下图所示,T K以上转变为右下图所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同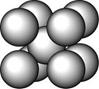

(1)在T K以下的纯A晶体中,与A原子等距离且最近的A原子数为______个;在T K以上的纯A晶体中,与A原子等距离且最近的A原子数为___________;
(2)纯A晶体在晶型转变前后,二者基本结构单元的边长之比为(TK以上与TK以下之比)___________。
(3)左上图的的堆积方式为, 经测定其结构和性质参数如下表所示
| 金属 |
相对原子质量 |
分区 |
密度/g·㎝-3 |
原子化热/kJ·mol-1 |
| Na |
22.99 |
s区 |
0.960 |
108.4 |
| A |
60.20 |
d区 |
7.407 |
7735 |
则A原子的原子半径为pm,试解释该晶体原子化热很高的原因。
(已知 ,7.407≈
,7.407≈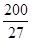 ,1pm=10
,1pm=10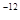 m)
m)