将pH试纸用蒸馏水湿润后,去测定某溶液的pH值,测得该溶液的pH值结果将会:
| A.偏高 | B.偏低 | C.不变 | D.上述三种情况均有可能 |
下列叙述正确的是:
| A.Li在氧气中燃烧主要生成Li2O2 |
| B.将CO2通入溶有漂粉精的水溶液中可生成次氯酸 |
| C.将SO2通入CaCl2溶液可生成CaSO3沉淀 |
| D.将NH3通入热的CuSO4溶液中可使Cu2+还原成Cu |
下列家庭实验中不涉及化学变化的是:
| A.用熟苹果催熟青香蕉 | B.用少量食醋除去水壶中的水垢 |
| C.用糯米、酒曲和水制甜酒酿 | D.用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐 |
如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态(提示:物质X、Y的状态均未知,物质Z的状态为气态):2X(?)+ Y(?) a Z(g)
a Z(g)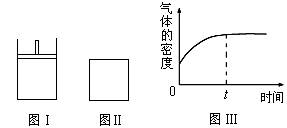
此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是
| A.物质Z的化学计量数a = 2 |
| B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态 |
| C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ |
| D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |
某CuSO4、Al2(SO4)3、H2SO4的混合溶液100mL(本题均不考虑水解影响),已知溶液中阳离子的浓度相同,且SO42-的物质的量浓度为6mol·L-1,则此溶液最多溶解铁粉的质量为
| A.5.6 g | B.16.8g | C.22.4g | D.33.6g |
央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如右下图所示,下列说法不正确的是
| A.该有机物的分子式为C7H8O3 |
| B.1 mol该有机物最多能与3 mol H2发生加成反应 |
| C.该有机物能发生取代、加成、氧化和还原反应 |
| D.该有机物的一种芳香族同分异构体能发生银镜反应 |