(10分)海水中化学资源的综合开发利用已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,下图为提取它们的步骤: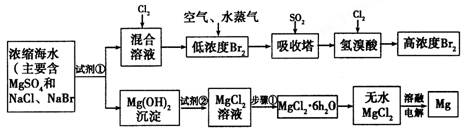
请回答:
I.从海水中提取的溴占世界年产量的1/3,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时,第一次通入Cl2发生反应的离子方程式是__________________。
(2)吸收塔中反应的离子方程式是________________________________________。
由(1)、(2)可知,SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
__________________。( 用“”表示)
II.镁及其合金是用途很广泛的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用___________(写化学式)。
(2)加入试剂②后反应泊离子方程式是_________________________________。
(3)步骤①包括加热、蒸发、冷却、结晶、_________。
(4)通电时无水MgCl2在熔融状态下反应的化学方程式是
___________________________________________________。
III.上述流程在生产溴和镁的同时还可以制得其他化工物质,比如制备耐火材料氧化镁和盐酸。生产方法是:
①将氯化镁晶体(MgCl2·6H2O)加热到523OC以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体。
②将两种气体冷却到室温,再根据需要,加入不同量的水,就可得到不同浓度的盐酸。
(1)MgCl2·6H2O在523OC以上分解的化学方程式是_____________________________。
(2)现用1mol MgCl2·6H2O分解所得的非固体产物来制取密度为1.19g/cm3的盐酸溶液168mL,需加水__________g(精确到0.1),该盐酸中溶质的物质的量浓度是____________mol/L(精确到0.1)。
肼(N2H4)又称联氨,其液体可燃,燃烧热较大且燃烧产物对环境无污染,可以用作火箭燃料。肼溶于水是一种二元碱。
完成下列填空:
(1)写出肼的电子式,肼的晶体类型。
(2)工业上可用次氯酸钠和氨反应制肼,若只有一种氧化产物。写出该方法制备肼的化学方程式。
(3)0.2mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出128.3kJ的热量。
写出该反应的热化学方程式。
(4)室温下,N2H5Cl的水溶液显(填酸、碱、中)性。
其原因是。
已知:H2O  H + + OH-Kw = 1×10-14
H + + OH-Kw = 1×10-14
N2H4 + H2O  [N2H5]+ + OH- K1 = 8.5×10-7
[N2H5]+ + OH- K1 = 8.5×10-7
[N2H5]+ + H2O  [N2H6]2++ OH-K2 = 8.4×10-15
[N2H6]2++ OH-K2 = 8.4×10-15
(5)肼可以和氧气反应N2H4+O2→N2+2H2O。为除去高压锅炉用水中溶解的O2,常用N2H4或Na2SO3。除去等物质的量的O2,所消耗的N2H4和Na2SO3的质量之比为。
与N2H4相比较,使用Na2SO3会对锅炉造成不良的影响,其原因是。
A是一种重要的食用香料。存在于玉米、葡萄等多种食品中。主要用于配制奶油、乳品、酸奶和草莓等香精,也可用于有机合成。以A为原料制备阴离子树脂M和新型聚酯材料N等的合成路线如下: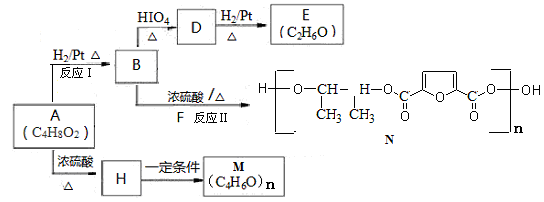
已知:Ⅰ.
Ⅱ.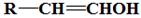 不稳定,很快转化为
不稳定,很快转化为
(1)反应Ⅰ的反应类型是。
(2)B中官能团的名称是。
(3)D与新制Cu(OH)2反应的化学方程式是。
(4)下列关于E的说法正确的是。
a.不溶于水 b.能与H2发生还原反应
c.能被重铬酸钾酸性溶液氧化d.与NaOH醇溶液共热发生消去反应
(5)M的结构简式是。
(6)反应Ⅱ的化学方程式是。
(7)A的属于酯类的同分异构体有____种,其中只含一个甲基的同分异构的结构简式是:。
工业上采用下列工艺流程将石油废气中的硫化氢转化为硫酸和氢气等产品以防止污染。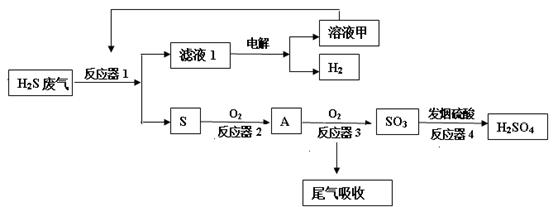
(1)反应器1中装有硫酸铁的酸性溶液。
①配制硫酸铁溶液时,需加入适量的硫酸,请用化学平衡移动原理解释原因。
②反应器1中发生反应的离子方程式是______.
(2)反应器3中发生反应的化学方程式是。
(3)工业上用氨水和热空气吸收处理尾气中的二氧化硫以生产氮肥,该反应的化学方程式是______.
(4)电解滤液1的工作原理示意图如下: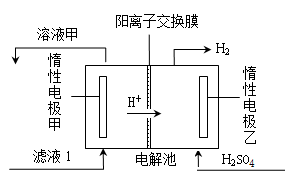
①乙电极是(填“阴”或“阳”)极。
②甲电极的电极反应式是。
③电解滤液1的离子方程式是。
铁是当代社会中用量最大的金属之一。磁铁矿是工业上冶炼铁的原料之一,发生的主要反应为:Fe3O4(s)+4CO 3Fe(s)+4CO2
3Fe(s)+4CO2
(1)已知:①Fe3O4(s)+4C(石墨) 3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
②C(石墨)+CO2(g) 2CO(g) ΔH=+172.5 kJ/mol
2CO(g) ΔH=+172.5 kJ/mol
由Fe3O4(s)与CO反应生成Fe(s)的热化学方程式是。
(2)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0 mol ,10 min反应达到平衡时,容器中CO2的浓度是0.4 mol /L。
①能证明该反应达到化学平衡的是(选填字母)。
a.容器内压强不再变化
b.容器内CO、CO2物质的量比为1 : 1
c.容器内气体的质量不再变化
d.生成CO2的速率与消耗CO的速率相等
②CO的平衡转化率是。
③l0 min内,反应的平均反应速率v (CO2)=。
④欲提高该反应中CO的平衡转化率,可采取的措施是(选填字母)。
a.提高反应温度 b.移出部分CO2
c.加入合适的催化剂 d.减小容器的容积
⑤T℃时,该反应的平衡常数K=。
6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍。用化学用语回答下列问题:
| X |
Y |
Z |
|
| W |
M |
Q |
(1)Y在周期表中的位置是________。
(2)X、Y、Z三种元素的原子半径由大到小的顺序是________。
(3)W、M、Q三种元素最高价氧化物对应的水化物中,酸性由强到弱的顺序是________。
(4)W的最高价氧化物可以和Z的氢化物反应,利用该反应可刻蚀玻璃,反应的化学方程式是________。
(5)X的含10个电子的气态氢化物甲是一种重要的化工原料。甲的电子式是,实验室制备甲的化学方程式是________,甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是。X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是。
(6)工业上用下图所示装置电解Q元素的钠盐溶液丁,获得一种含Q元素的消毒剂。该反应的离子方程式是。