合成高分子材料用途广泛、性能优异,其功能与分子结构有密切的关系。
下面是几种高分子材料的结构简式:
(1)A是天然橡胶的主要成分,易老化,A中含有的官能团的名称是____________,天然橡胶__________(填“能”或“否”)使酸性高锰酸钾溶液褪色。
(2)B的单体是苯酚和___________,这两种单体在碱催化下,可得到网状高分子化合物,俗称电木,是(填“热塑性”或“热固性”)_________塑料。
(3)C与NaOH溶液在一定条件下反应,生成高吸水性树脂,该树脂的结构简式__________________________。
(4)D是合成纤维中目前产量第一的聚酯纤维——涤纶,可由两种单体在一定条件下合成,该合成反应的化学方程式是__________________________________。
香豆素类化合物具有抗病毒、抗癌等多种生物活性。香豆素 3
3 羧酸可由水杨醛
羧酸可由水杨醛
制备。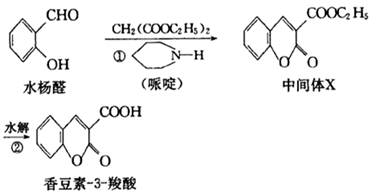
(1)中间体X的化学式为 。
(2)水杨醛发生银镜反应的化学方程式为 。
(3)香豆素 3
3 羧酸在NaOH溶液中彻底水解生成的有机物的结构简式为。
羧酸在NaOH溶液中彻底水解生成的有机物的结构简式为。
(4)下列说法中错误的是()
| A.中间体X不易溶于水 |
| B.水杨醛分子中所有原子一定处于同一平面 |
| C.水杨醛除本身外,含有苯环且无其他环的同分异构体还有4种 |
D.水杨醛和香豆素 3 3 羧酸都能使酸性高锰酸钾溶液褪色 羧酸都能使酸性高锰酸钾溶液褪色 |
(5)反应①中的催化剂“哌啶”可以由“吡啶”合成,其反应为: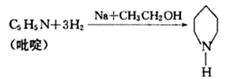
已知吡啶为环状,性质与苯类似。则吡啶的结构简式为 ;吡啶与混酸(浓硝酸与浓硫酸混合物)在加热条件下,发生硝化反应生成氮原子间位的一取代物的化学方程式为。
扑热息痛(学名对乙酰氨基酚)是生活中常用到的一种解热镇痛药。以苯为原料合成扑热息痛的部分转化如下: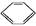
 A
A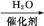 B
B C
C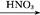
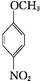 →…→D
→…→D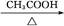
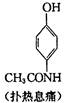
请回答下列问题:
(1)B→C的反应类型为 ,D中官能团的名称为 。
(2)C的结构简式为 。
(3)1 mol 扑热息痛与足量NaOH溶液反应,理论上消耗NaOH的物质的量为 mol。
(4)实验证明B能够与溴水反应,试写出其反应的化学方程式: 。
(5)扑热息痛有多种同分异构体,同时符合下列要求的同分异构体有 种。
①苯环上有两个对位取代基 ②属于氨基酸
011年5月份,受到拉尼娜现象和全球大气环流异常共同作用的影响,我国南方出现了罕见的旱情,为此专家建议尽快发展高能抗旱保水剂用来调控农田水分和作物耗水,减缓水资源短缺和干旱的危害。已知有机物I为一种保水剂,可通过烃A经下列转化生成:
提示: 不能稳定存在。
不能稳定存在。
请回答下列问题:
(1)A和I的结构简式为:A ,I 。
(2)F中官能团的名称为: 。
(3)反应②和⑦的反应类型为:② ,⑦ 。
(4)反应④的化学方程式为 。
(5)M是一种普遍使用的抗生素类药物,它是由2个F分子在一定条件下脱去2个水分子形成的环状酯,写出该反应的化学方程式: 。
(6)D有两种能发生银镜反应且属于链状化合物的稳定同分异构体,请写出它们的结构简式: 。
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
(1)写出G的含氧官能团的名称 ;B→C的反应类型是 。
(2)写出D E的化学方程式: 。
E的化学方程式: 。
(3)满足下列条件的D的同分异构体有 种。
①能发生银镜反应;②能使FeCl3溶液显色;③酯类。
(4)下列关于G的说法正确的是
a.能使溴水褪色
b.能与金属钠反应
c.1 mol G最多能和3 mol氢气反应
d.分子式是C9H8O3
某烃A的相对分子质量为84。回答下列问题:
(1)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不相等的是(填序号) 。
a.C7H12O2 b.C6H14 c.C6H14O d.C7H14O3
(2)若烃A为链烃,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种。
①A的结构简式为 ;
②链烃A与溴的CCl4溶液反应生成B,B与NaOH的醇溶液共热可得到D,D分子中无溴原子。请写出由B制备D的化学方程式:;
③B与足量NaOH水溶液完全反应,生成有机物E,该反应的化学方程式:;E与乙二醇的关系是。
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3∶2∶1,则A的名称为。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为。